
| 实验编号 | 待测液体积 (mL) | 酸性KMnO4体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 1 | 20.00 | 0.10 | 16.58 |
| 2 | 20.00 | 0.00 | 15.98 |
| 3 | 20.00 | 0.10 | 16.12 |
| c(标注)×V(标准) |
| V(待测) |
| 15.98mL+16.02mL |
| 2 |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
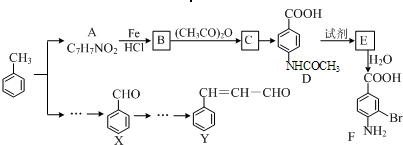

| NaOH |
| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、NH4+、NO3-、Cl- |
| B、Ba2+、Na+、NO3-、CO32- |
| C、K+、Mg2+、SO42-、CO32- |
| D、H+、Na+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:


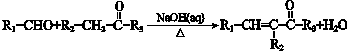
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
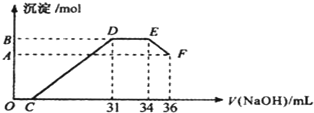
查看答案和解析>>
科目:高中化学 来源: 题型:
 )和抗癫痫药物H(
)和抗癫痫药物H( )的路线如下(部分反应略去条件和试剂):
)的路线如下(部分反应略去条件和试剂):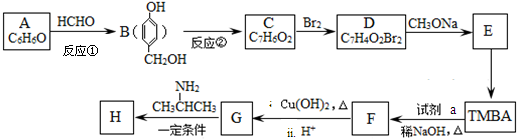
| 释NaOH,△ |
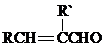 +H2O(R、R′表示烃基或氢)
+H2O(R、R′表示烃基或氢) )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
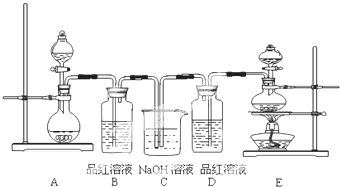
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com