
��1���ϳɰ���ҵ������������Ȼ����ˮ��Ӧ�Ʊ�������Ҫ��ӦΪ��
CH4(g)+ 2H2O(g) 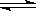 CO2(g)+4H2(g)
CO2(g)+4H2(g)
��Ӧ�����������仯��ͼ��ʾ��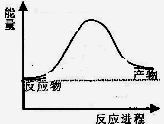
��÷�ӦΪ ��Ӧ������ȡ����ȡ���
����֪���ƻ�1mol��ѧ����Ҫ���յ��������±���ʾ��
| ��ѧ�� | C��H | O��H | C=O | H��H |
| ����������kJ/mol�� | a | b | c | d |
 CO2(g)+4H2 (g)��Ӧ�� ��Ӧ���е�4sʱCO2��Ũ��Ϊ0.08mol/L���ٹ�һ��ʱ�䷴Ӧ��ƽ�⣬ƽ��ʱ������ѹǿ����ʼʱ��1.4����
CO2(g)+4H2 (g)��Ӧ�� ��Ӧ���е�4sʱCO2��Ũ��Ϊ0.08mol/L���ٹ�һ��ʱ�䷴Ӧ��ƽ�⣬ƽ��ʱ������ѹǿ����ʼʱ��1.4������1�����ȣ�4a+4b-2c-4d
��2��
��
��


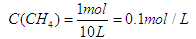
���������������1��������ת����ϵͼ��֪��Ӧ����������������Ũ�ȣ��ʸ÷�ӦΪ���ȷ�Ӧ�����ڷ�ӦCH4(g)+ 2H2O (g)  CO2(g)+4H2(g)���ƻ���Ӧ���л�ѧ������������Ϊ4a+4b���γ��������л�ѧ�����ͷ�����Ϊ2c+4d����÷�Ӧ���յ�����Ϊ4a+4b-2c-4d����2����������ʽ���м��㡣
CO2(g)+4H2(g)���ƻ���Ӧ���л�ѧ������������Ϊ4a+4b���γ��������л�ѧ�����ͷ�����Ϊ2c+4d����÷�Ӧ���յ�����Ϊ4a+4b-2c-4d����2����������ʽ���м��㡣
���㣺���黯ѧ��Ӧ����������ѧ��Ӧ���ʺͻ�ѧƽ��ļ�������֪ʶ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
36g̼����ȫȼ�����������У�COռ����֮һ�����CO2ռ����֮���������֪��2C(s)+O2(g)=2CO(g)��H=-110.5kJ/mol,2CO(g)+O2(g) =2CO2(g)��H=-566kJ/mol,����Щ̼��ȫȼ����ȣ���ʧ�������ǣ� ��
| A��172.5kJ | B��1149kJ | C��517.5kJ | D��283kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��16�֣���ҵ�Ͽ���ú����Ȼ���������������ж���;������CH4��
��1��д��CO2��H2��Ӧ����CH4��H2O���Ȼ�ѧ����ʽ ��
��֪�� �� CO(g)+H2O(g) H2(g)+CO2(g) ��H����41kJ��mol��1
H2(g)+CO2(g) ��H����41kJ��mol��1
�� C(s)+2H2(g) CH4(g) ��H����73kJ��mol��1
CH4(g) ��H����73kJ��mol��1
�� 2CO(g) C(s)+CO2(g) ��H����171kJ��mol��1
C(s)+CO2(g) ��H����171kJ��mol��1
��2����һ����CH4��;����CO(g)+3H2(g) CH4(g)+H2O(g)������������ͬʱ��H2��ƽ��ת�����ڲ�ͬѹǿ�����¶ȵı仯��ͼ��ʾ��
CH4(g)+H2O(g)������������ͬʱ��H2��ƽ��ת�����ڲ�ͬѹǿ�����¶ȵı仯��ͼ��ʾ��
�ٸ÷�Ӧ�ġ�H 0�����������������������
��ʵ�������в���ͼ��M�������N���Ӧ�ķ�Ӧ���������û�ѧ��Ӧ���ʺ�ƽ��֪ʶ��ͬʱ��������ʵ�ʣ�˵��ѡ��÷�Ӧ����������________________________��
��ij�¶��£���0.1 mol CO��0.3 mol H2����10L���ܱ������ڷ�����ӦCO(g)+3H2(g)  CH4(g)+H2O(g)��ƽ��ʱH2��ת����Ϊ80%������¶��¸÷�Ӧ��ƽ�ⳣ��K����д��������̣�������������λ��Ч���֣�
CH4(g)+H2O(g)��ƽ��ʱH2��ת����Ϊ80%������¶��¸÷�Ӧ��ƽ�ⳣ��K����д��������̣�������������λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��15�֣������ѣ�DME���ͼ״���21����Ӧ����㷺���������ȼ�ϣ�Ŀǰ��ҵ�Ͼ����ɺϳ������ض������������Ƶá�
��1���ɺϳ����Ʊ������ѵ���Ҫԭ�����£�
��֪����CO(g)��2H2(g) CH3OH(g) ��H1����90.7 kJ��mol��1
CH3OH(g) ��H1����90.7 kJ��mol��1
��2CH3OH(g) CH3OCH3(g)��H2O(g) ��H2����23.5 kJ��mol��1
CH3OCH3(g)��H2O(g) ��H2����23.5 kJ��mol��1
��CO(g)��H2O(g) CO2(g)��H2(g) ��H3����41.2 kJ��mol��1
CO2(g)��H2(g) ��H3����41.2 kJ��mol��1
��Ӧ3H2(g)��3CO(g) CH3OCH3(g)��CO2(g)�ġ�H�� kJ��mol-1��
CH3OCH3(g)��CO2(g)�ġ�H�� kJ��mol-1��
��2�����ϳ�����n(H2)/n(CO)=2ͨ��1 L�ķ�Ӧ���У�һ�������·�����Ӧ��
4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)������CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ��ʾ��
CH3OCH3(g)+H2O(g)������CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ��ʾ��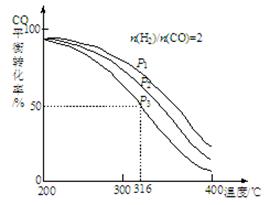
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ ��P1��P2��P3�ɴ�С��˳��Ϊ ��
������Ӧ��P3��316��ʱ����ʼʱn(H2)/n(CO)=3����ﵽƽ��ʱ��CO��ת���� 50��������ڡ�����С�ڡ����ڡ�)��
��3���ɺϳ����ϳɼ״��ķ�Ӧ���¶���ƽ�ⳣ����K���Ĺ�ϵ������ݣ�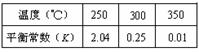
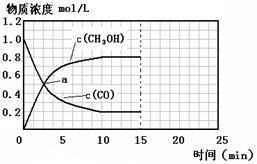
250��ʱ����2 molCO��6 molH2����2L���ܱ������з�����Ӧ����Ӧʱ��������Ũ�ȵĹ�ϵ��ͼ��ʾ����ǰ10�����ڣ�������ƽ����Ӧ����Ϊ ����15����ʱ��ֻ�ı��¶�һ��������������20����ʱ�ﵽ��ƽ�⣬������ת����Ϊ33.3%����ʱ�¶�Ϊ �����ϱ���ѡ��������ͼ�л���15��25����c (CH3OH)�ı仯���ߡ�
��4�����ü״�Һ����ˮҲ���Ʊ������ѣ�ԭ���ǣ�CH3OH +H2SO4��CH3HSO4+H2O��CH3HSO4+CH3OH��CH3OCH3+H2SO4����ϳ����Ʊ������ѱȽϣ��ù��յ��ŵ��Ƿ�Ӧ�¶ȵͣ�ת���ʸߣ���ȱ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��Ӧ���̵������仯��ͼ��ʾ����֪l mol SO2(g)����Ϊ1 molSO3 (g)��
��Ӧ���̵������仯��ͼ��ʾ����֪l mol SO2(g)����Ϊ1 molSO3 (g)�� ����ش������⣻
����ش������⣻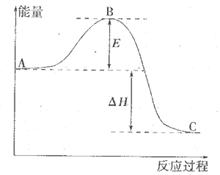
��1��E��ʾ___________________��E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ��__________����С����ޡ���Ӱ�졣
��2���÷�Ӧͨ����V2O5����������V2O5��ʹͼ�С�H___________����������С�����䡱����������________��
��3����֪�������ȼ����Ϊ296 kJ��mol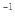 ��������S(s)����2mol SO3(g)�ġ�H ��________________��
��������S(s)����2mol SO3(g)�ġ�H ��________________��
��4����һ�����������ݻ�Ϊ2L��������ͨ��4molSO2��3molO2����ַ�Ӧ��ƽ���SO3���������Ϊ1/3��������ͬ�����������ݻ�Ϊ2L��������ͨ��amolSO2�ͣ�bmolSO3����cmol����Ӧ���淴Ӧ��������Ҵﵽƽ��ʱSO3���������ҲΪ1/3����c��ȡֵ��ΧΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ſ�ѧ�����Ľ��������������˶��ּ״����ӽ���Ĥȼ�ϵ�أ������㲻ͬ������
��1����һ��״����ӽ���Ĥȼ�ϵ�أ��轫�״�����ת��Ϊ���������ַ�Ӧԭ����
A��CH3OH(g)��H2O(g)��CO2(g)��3H2(g) ��H����49.0kJ/mol
B��CH3OH(g)��3/2O2(g)��CO2(g)��2H2O(g) ��H����192.9kJ/mol
��֪H2O(l)��H2O(g) ��H����44 kJ/mol����д��32g��CH3OH(g)��ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ ��
��2����ͼ��ij�ʼDZ������ü״����ӽ���Ĥȼ�ϵ�صĽṹʾ��ͼ���״��ڴ����������ṩ���Ӻ͵��ӣ����Ӿ����·�����Ӿ��ڵ�·������һ����������Ӧ������ܷ�ӦΪ��2CH3OH��3O2��2CO2��4H2O����c�缫�� �������������������
c�缫�Ϸ����ĵ缫��Ӧʽ�� ��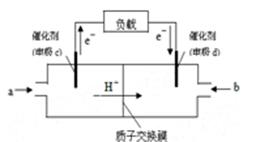
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��16�֣�����β���dz��п�������Ҫ��Ⱦ��֮һ������Ҫ�к��ɷ���CO���������NOx���ȡ�
��1��NOx������ԭ��֮һ����������������ʱ����N2��O2��Ӧ���������仯ֵ����ͼ��ʾ��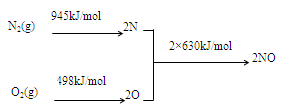
��N2(g)��O2(g) 2NO(g) ��H=���� ��
2NO(g) ��H=���� ��
��2������β����CO��NOx����Ч������Ϊ�����������Ҫ���⡣ij�о�С����ʵ������ij���ʹ�����CO��NO��ת�������о������NOת��ΪN2��ת�������¶ȡ�CO������ı仯�������ͼһ��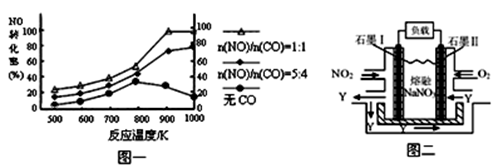
�� NO��CO���ʱ�����Ӧ�Ļ�ѧ����ʽΪ ��
�� 1000K��n(NO)/n(CO)=5:4ʱ��NO��ת����Ϊ75%����CO��ת����ԼΪ ��
�� ����n(NO)/n(CO)��ʵ�ʹ������Dz��ϱ仯�ģ���֤NOת���ʽϸߵĴ�ʩ�ǽ��¶ȴ�Լ������ K֮�䡣
��3������β����NOx����ͨ��ȼ�ϵ��ʵ��ת�����Ѿ������� NO2��O2������NaNO3�Ƴ���ȼ�ϵ�أ���ԭ����ͼ����
�� ͼ��ʯī��Ϊ��ص� ����
�� �ڸõ��ʹ�ù����У�ʯīI�缫�ϵIJ�����������Y����缫��ӦʽΪ ��
��4���״�Ҳ������ȼ�ϵ�ء���ҵ�ϲ��÷�ӦCO2(g)+3H2(g)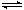 CH3OH(g)+H2O(g) ��H<0�ϳɼ״���
CH3OH(g)+H2O(g) ��H<0�ϳɼ״���
�� �ں����ܱշ�Ӧ���У�H2��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�
ϵ��ͼ����ʾ����A��B��C���㴦��Ӧƽ�ⳣ��(KA��KB��KC)��
��С��ϵΪ ��
�� ij�����£���6molCO2��8molH2����2L�ܱ������з���
��Ӧ���ﵽƽ�����c(CO2)=2.0mol��L-1������¶��·�Ӧ��ƽ
�ⳣ��ֵΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��I�����������ѳ�Ϊ��ǰ��δ����һ��ȫ���Կ��⡣Ϊ���Ŀǰȼ��ʹ�ù����еĻ�����Ⱦ���⣬��������ԴΣ�����е�ר���������̫���ܴ�ʹȼ��ѭ��ʹ�õĹ��룬��ͼ��ʾ��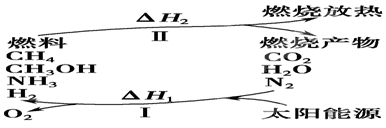
��ش��������⣺
(1)���̢������ת����ʽΪ________��ת��Ϊ________�ܡ�
(2)����ת�������У���H1�ͦ�H2�Ĺ�ϵ��________��
(3)����1 mol��ѧ��������������±���
| ���ۼ� | H��N | H��O | N��N | O��O |
| ����1 mol��ѧ����������/(kJ��mol��1) | 393 | 460 | 941 | 499 |
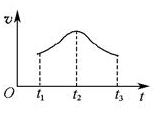 ���Խ���t1��t2��t2��t3���ʱ仯��ԭ��______________________________________________________��
���Խ���t1��t2��t2��t3���ʱ仯��ԭ��______________________________________________________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪��Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g)����H=akJ��mol-1,ƽ�ⳣ��ΪK;
FeO(s)+CO(g)����H=akJ��mol-1,ƽ�ⳣ��ΪK;
��Ӧ��CO(g)+1/2O2(g) CO2(g)����H=bkJ��mol-1;
CO2(g)����H=bkJ��mol-1;
��Ӧ��Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)����H=ckJ��mol-1������ڲ�ͬ�¶���,Kֵ����:
2Fe(s)+3CO2(g)����H=ckJ��mol-1������ڲ�ͬ�¶���,Kֵ����:
| �¶�/�� | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
 2FeO(s)�Ħ�H=����������
2FeO(s)�Ħ�H=���������� �鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com