
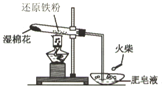
 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.| HCl |
| 足量Fe粉 |
| NaOH |
| ||
| ||


科目:高中化学 来源: 题型:
| A、含有 NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B、在常温常压下,64g SO2中含有的原子数为3NA |
| C、25℃,1.01×105Pa,11.2L Cl2含有的分子数为0.5NA |
| D、在标准状况下,11.2L H2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表一部分,表中所列字母分别代表某一化学元素.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | a | ||||||
| 2 | b | c | d | e | f | ||
| 3 | g | h |
| 代表符号 | b | c | d | e | f |
| 氢化物 沸点(℃) | 1317 | -161.5 | -33.33 | 100 | 19.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液起始读数 | NaOH溶液终点读数 | |
| 第一次 | 0.02mL | 18.60mL |
| 第二次 | 0.04mL | 18.66mL |
| 第三次 | 0.20mL | 20.60mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| KMnO4(H+) |
| kmNo4(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将过量的SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | 生成了BaSO3 |
| B | 常温下将Al片插入浓硫酸中 | 无明显现象 | Al片和浓硫酸不反应 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 将SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na→NaOH→Na2CO3→NaCl |
| B、Fe→FeCl3→Fe(OH)3→Fe2O3 |
| C、Mg→MgCl2→Mg(OH)2→MgSO4 |
| D、Al→Al2O3→Al(OH)3→AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com