
【题目】有机化合物H的结构简式为![]() ,其合成路线如下(部分反应略去试剂和条件):
,其合成路线如下(部分反应略去试剂和条件):
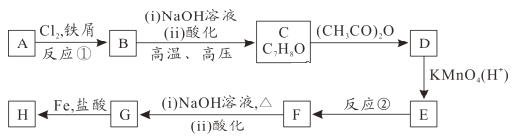
已知:①![]()
②![]() (苯胺易被氧化)
(苯胺易被氧化)
请回答下列问题:
(1)烃A的名称为_______,B中官能团为_______,H的分子式为_______,反应②的反应类型是_______。
(2)上述流程中设计C→D的目的是_______。
(3)写出D与足量NaOH溶液反应的化学方程式为_______。
(4)符合下列条件的D的同分异构体共有_______种。
A.属于芳香族化合物 B.既能发生银镜反应又能发生水解反应
写出其中核磁共振氢谱图中峰面积之比为6∶2∶1∶1的同分异构体的结构简式:______。(任写一种)
(5)已知:苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位,据此按先后顺序写出以烃A为原料合成邻氨基苯甲酸(![]() )合成路线(无机试剂任选)。_______
)合成路线(无机试剂任选)。_______
【答案】甲苯 氯原子或-Cl C7H7O3N 取代反应或硝化反应 保护(酚)羟基不被氧化 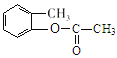 +2NaOH
+2NaOH![]() +CH3COONa+H2O 14
+CH3COONa+H2O 14 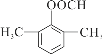 或
或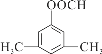
![]()
【解析】
H的结构简式为![]() ,逆推可知G为
,逆推可知G为![]() 。纵观整个过程,可知烃A为芳香烃,结合C的分子式C7H8O,可知A为
。纵观整个过程,可知烃A为芳香烃,结合C的分子式C7H8O,可知A为![]() ,A与Cl2发生苯环上氯代反应生成B,B中氯原子发生水解反应、酸化引入-OH生成C,C中酚羟基发生信息①中取代反应生成D,D与酸性KMnO4溶液反应,D中-CH3被氧化成-COOH生成E,E→F转化中在苯环上引入硝基-NO2,F→G的转化重新引入酚羟基,可知C→D的转化目的防止酚羟基被氧化,结合H的结构简式,可推知B为
,A与Cl2发生苯环上氯代反应生成B,B中氯原子发生水解反应、酸化引入-OH生成C,C中酚羟基发生信息①中取代反应生成D,D与酸性KMnO4溶液反应,D中-CH3被氧化成-COOH生成E,E→F转化中在苯环上引入硝基-NO2,F→G的转化重新引入酚羟基,可知C→D的转化目的防止酚羟基被氧化,结合H的结构简式,可推知B为![]() 、C为
、C为![]() 、D为
、D为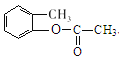 、E为
、E为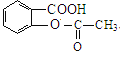 、F为
、F为![]() 。
。
(5)甲基氧化引入羧基,硝基还原引入氨基,由于氨基易被氧化,应先把甲基氧化为羧基后再将硝基还原为氨基,结合苯环引入基团的定位规律,甲苯先和浓硝酸发生取代反应生成邻硝基甲苯,然后邻硝基甲苯再被酸性高锰酸钾溶液氧化生成邻硝基苯甲酸,最后邻硝基苯甲酸和Fe、HCl反应生成邻氨基苯甲酸。
根据上述分析可知:A为![]() ,B为
,B为![]() 、C为
、C为![]() 、D为
、D为 、E为
、E为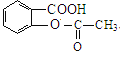 、F为
、F为![]() ,G为
,G为![]() ,H为
,H为![]() 。
。
(1)烃A为![]() ,A的名称为甲苯。B为
,A的名称为甲苯。B为![]() ,B中官能团为氯原子。H的结构简式为
,B中官能团为氯原子。H的结构简式为![]() ,H的分子式为C7H7O3N。反应②是苯环上引入硝基,反应类型是:取代反应;
,H的分子式为C7H7O3N。反应②是苯环上引入硝基,反应类型是:取代反应;
(2)C→D中消除酚羟基,F→G中又重新引入酚羟基,而酚羟基容易被氧化,所以流程中设计C→D的目的是:保护(酚)羟基不被氧化;
(3)D是 ,D与足量NaOH溶液发生酯的水解反应,化学方程式为:
,D与足量NaOH溶液发生酯的水解反应,化学方程式为: +2NaOH
+2NaOH![]() +CH3COONa+H2O,
+CH3COONa+H2O,
(4)D为 ,其符合下列条件的同分异构体:A.属于芳香族化合物,说明含有苯环;B.既能发生银镜反应又能发生水解反应,说明含有-OOCH基团。只有1个取代基为-CH2CH2OOCH和-CH(CH3)OOCH两种不同结构;有2个取代基为-CH3、-CH2COOH,或者-CH2CH3、-OOCH,这两种情况均有邻、间、对3种位置结构,种类数为2×3=6种;有3个取代基为-CH3、-CH3、-OOCH,2个甲基有邻、间、对3种位置结构,对应的-OOCH分别有2种、3种、1种位置,故符合条件的共有2+3×2+2+3+1=14种。其中核磁共振氢谱图中峰面积之比为6:2:1:1的同分异构体的结构简式:
,其符合下列条件的同分异构体:A.属于芳香族化合物,说明含有苯环;B.既能发生银镜反应又能发生水解反应,说明含有-OOCH基团。只有1个取代基为-CH2CH2OOCH和-CH(CH3)OOCH两种不同结构;有2个取代基为-CH3、-CH2COOH,或者-CH2CH3、-OOCH,这两种情况均有邻、间、对3种位置结构,种类数为2×3=6种;有3个取代基为-CH3、-CH3、-OOCH,2个甲基有邻、间、对3种位置结构,对应的-OOCH分别有2种、3种、1种位置,故符合条件的共有2+3×2+2+3+1=14种。其中核磁共振氢谱图中峰面积之比为6:2:1:1的同分异构体的结构简式: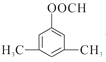 或
或 。
。
(5)以甲苯为原料合成![]() 的方法是:先使甲苯发生取代反应产生邻硝基甲苯,用酸性KMnO4氧化甲基为—COOH,得到邻硝基甲苯,用Fe在HCl存在条件下发生还原反应,—NO2被还原得到—NH2,就生成邻氨基苯甲酸。故合成路线流程图为:
的方法是:先使甲苯发生取代反应产生邻硝基甲苯,用酸性KMnO4氧化甲基为—COOH,得到邻硝基甲苯,用Fe在HCl存在条件下发生还原反应,—NO2被还原得到—NH2,就生成邻氨基苯甲酸。故合成路线流程图为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图像的说法中,正确的是( )
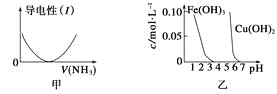
A.图甲表示向乙酸溶液中通入NH3过程中溶液导电性的变化
B.由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右
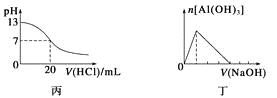
C.图丙表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
D.图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下,设计并进行了以下一系列实验,实验结果记录如下。
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
① |
| 稀盐酸 | 偏向 |
② |
| 稀盐酸 | 偏向 |
③ |
| 稀盐酸 | 偏向石墨 |
④ |
| 氢氧化钠溶液 | 偏向 |
⑤ |
| 浓硝酸 | 偏向 |
试根据表中的电流表指针偏转方向回答下列问题:
(1)实验1、2中![]() 所作的电极(正极或负极)是否相同?________(填“相同”或“不相同”)。
所作的电极(正极或负极)是否相同?________(填“相同”或“不相同”)。
(2)由实验3完成下列填空:
①铝为________极,电极反应式为________________;
②石墨为________极,电极反应式为________________;
③电池总反应为________。
(3)实验4中铝作负极还是正极?________,理由是_______。写出铝电极的电极反应式:_______。
(4)解释实验5中电流表指针偏向铝的原因:_________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项不正确的是
序号 | 反应物及反应条件 | 产物 |
① |
|
|
② |
|
|
③ |
|
|
④ |
| Ag、 |
A.第①组反应固体X中不含Fe
B.第②组反应中![]() 全部被氧化为
全部被氧化为![]()
![]()
D.第④组反应中![]() 既是氧化剂又是还原剂
既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有CH4、C2H4、C2H6三种有机化合物:
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是__________。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是__________。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是__________,生成水最多的是__________。
(4)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取试剂级NaCl及回收金属Mg的工业流程如图:
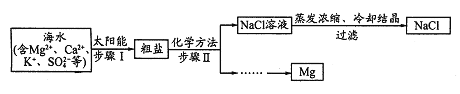
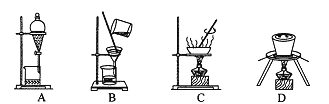
![]() 步骤I原理如图,在实验室中完成该步骤所用装置为 ______
步骤I原理如图,在实验室中完成该步骤所用装置为 ______ ![]() 填序号
填序号![]() 。
。
![]() 某学习小组设计了实验模拟步骤Ⅱ:
某学习小组设计了实验模拟步骤Ⅱ:
粗盐溶解![]() 过滤
过滤![]() NaCl溶液
NaCl溶液
![]() 该实验中加入
该实验中加入![]() 的作用是 ______ ;若向粗盐溶液中加入的是
的作用是 ______ ;若向粗盐溶液中加入的是![]() 浓溶液,则有难溶的
浓溶液,则有难溶的![]() 生成,同时有气体逸出.该反应的离子方程式为 ______。
生成,同时有气体逸出.该反应的离子方程式为 ______。
![]() 学习小组发现上述实验即使
学习小组发现上述实验即使![]() 用量不足,第
用量不足,第![]() 步沉淀中依然含有少量
步沉淀中依然含有少量![]() ,试从平衡角度分析 ______。
,试从平衡角度分析 ______。
![]() 在第
在第![]() 步后增加过滤,并从滤渣中得到
步后增加过滤,并从滤渣中得到![]() ,工业上通过电解获得Mg的化学方程式为 ______ ; 若
,工业上通过电解获得Mg的化学方程式为 ______ ; 若![]() 时直接将
时直接将![]() 熔融,然后用惰性电极电解,发现有固体剩余,则该固体可能是 ______
熔融,然后用惰性电极电解,发现有固体剩余,则该固体可能是 ______ ![]() 写化学式
写化学式![]() ;现有a g滤渣,用上二述方法处理回收Mg时产生标况下
;现有a g滤渣,用上二述方法处理回收Mg时产生标况下![]() ,剩余固体为c g。则滤渣中镁元素的质量分数为
,剩余固体为c g。则滤渣中镁元素的质量分数为 ![]() 不必化简
不必化简![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把图二的碎纸片补充到图一中,可得到一个完整的离子方程式。对该离子方程式说法正确的是
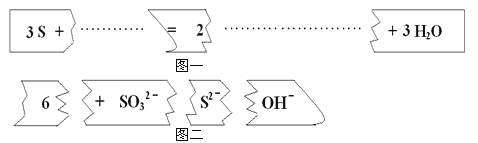
A. 配平后的化学计量数依次为3、1、2、6、3
B. 若有1mol的S被氧化,则生成2mol S2-
C. 氧化剂与还原剂的物质的量之比为1:2
D. 2mol的S参加反应有3mol的电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌![]() 是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如图所示。
是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如图所示。

![]() 为提高锌灰的浸取率,不宜采用的方法是______
为提高锌灰的浸取率,不宜采用的方法是______![]() 填序号
填序号![]() 。
。
![]() 研磨
研磨 ![]() 多次浸取
多次浸取 ![]() 升高温度
升高温度 ![]() 加压
加压 ![]() 搅拌
搅拌
![]() 步骤Ⅱ中
步骤Ⅱ中![]() 的作用是______,所得滤渣的主要成分是______
的作用是______,所得滤渣的主要成分是______![]() 写化学式
写化学式![]() 。
。
![]() 步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂X应为______。
步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂X应为______。
![]() 步骤Ⅳ还可以回收
步骤Ⅳ还可以回收![]() 来制取
来制取![]() 。
。
![]() 检验ZnS固体是否洗涤干净的方法是______。
检验ZnS固体是否洗涤干净的方法是______。
![]() 可由等物质的量的
可由等物质的量的![]() 和
和![]() 在高温、催化剂条件下制取,化学反应方程式为______。
在高温、催化剂条件下制取,化学反应方程式为______。
![]() 若步骤Ⅱ加入的
若步骤Ⅱ加入的![]() 为b mol,步骤Ⅲ所得Cd为d mol,最后得到V L,c
为b mol,步骤Ⅲ所得Cd为d mol,最后得到V L,c ![]() 的
的![]() 溶液。则理论上所用锌灰中含有锌元素的质量为______。
溶液。则理论上所用锌灰中含有锌元素的质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属的冶炼(“![]() ”前为原料,“
”前为原料,“![]() ”后为所得的金属),①MgCl2→Mg、②MnO2→Mn、③ZnO→Zn、④HgO→Hg、⑤磁铁矿→Fe、⑥NaCl→Na,其中最适宜用热还原法冶炼的是
”后为所得的金属),①MgCl2→Mg、②MnO2→Mn、③ZnO→Zn、④HgO→Hg、⑤磁铁矿→Fe、⑥NaCl→Na,其中最适宜用热还原法冶炼的是
A.①②④⑥B.③④C.②③⑤D.②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com