
分析 (1)N2和 H2按一定比例混合,在相同状况下其密度是H2的3.6倍,则平均相对分子质量为3.6×2=7.2,设氮气为xmol,氢气为ymol,则:$\frac{28x+2y}{x+y}$=7.2,据此进行计算;
(2)由(1)可知,0.5mol该混合气体,物质的量分别为0.1mol、0.4mol,则
3H2+N2?2NH3,
开始 0.4 0.1 0
转化 3n n 2n
平衡0.4-3n 0.1-n 2n
达到平衡后容器内压强是相同条件下反应前压强的0.76倍,则:$\frac{0.5-2n}{0.5}$=0.76,解得:n=0.06mol,以此计算平衡时混合气体中的氨的体积分数;
(3)根据(2)计算氮气的转化率.
解答 解:(1)N2和 H2按一定比例混合,在相同状况下其密度是H2的3.6倍,则平均相对分子质量为3.6×2=7.2,
设氮气为xmol,氢气为ymol,则:$\frac{28x+2y}{x+y}$=7.2,整理可得x:y=1:4,
相同条件下物质的量之比等于体积之比,所以体积为1:4,
故答案为:1:4;
(2)由(1)可知,0.5mol该混合气体,物质的量分别为0.1mol、0.4mol,则
3H2+N2?2NH3,
开始 0.4 0.1 0
转化 3n n 2n
平衡0.4-3n 0.1-n 2n
达到平衡后容器内压强是相同条件下反应前压强的0.76倍,则:$\frac{0.5-2n}{0.5}$=0.76,
解得:n=0.06mol,
所以达到平衡时混合气体中的氨的体积分数为:$\frac{2×0.06}{0.4-0.06×3+0.1-0.06+2×0.06}$=31.6%,
故答案为:31.6%;
(3)平衡时N2的转化率为:$\frac{0.06mol}{0.1mol}$×100%=60%,
故答案为:60%.
点评 本题考查化学平衡的计算,题目难度中等,明确化学平衡三段法计算的格式及平均相对分子质量、转化率的计算即可解答,侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 HC1$→_{△}^{MnO_{2}}$C12$\stackrel{石灰水}{→}$Ca(ClO)2(aq) | |
| B. | Al3+$\stackrel{过量氨水}{→}$A1O2-$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | A1$\stackrel{Na(OH)(aq)}{→}$NaA1O2(aq) $\stackrel{△}{→}$NaAlO2(s) | |
| D. | MgO(s) $\stackrel{HNO_{3}(aq)}{→}$Mg(NO3)2(aq)$\stackrel{电解}{→}$Mg(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
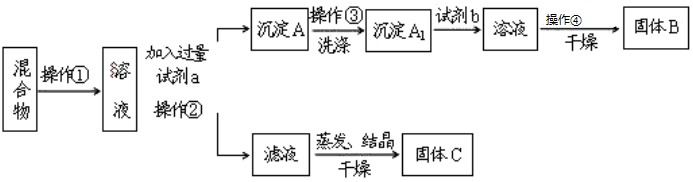
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L 1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,24gNO2中所含的氧原子数为0.5NA | |
| C. | 常温常压下,11.2LCl2与足量Fe反应,转移电子数为NA | |
| D. | 1mol的羟基与1mol的氢氧根离子所含质子数均为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
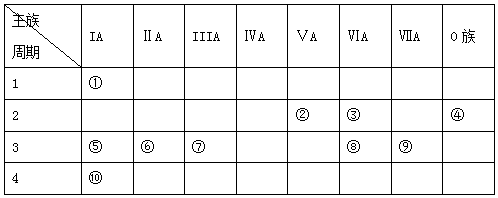
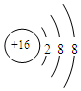 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入Ba(NO3)2溶液中有白色沉淀:SO2+Ba2++H2O═BaSO3↓+2H+ | |
| B. | 0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| C. | “84”消毒液和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+Cl-+6H+═Cl2+3H2O | |
| D. | 氯化铁溶液中滴加氢硫酸溶液:2Fe3++S2-═2Fe2++S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com