
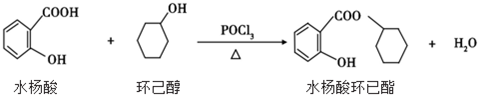
| A. | 水杨酸的核磁共振氢谱有 4 个吸收峰 | |
| B. | 水杨酸、环已醇和水杨酸环已酯都能与 FeCl3 溶液发生显色反应 | |
| C. | 1mol 水杨酸跟浓溴水反应时,最多消耗 2molBr2 | |
| D. | 1mol 水杨酸环已酯在 NaOH 溶液中水解时,最多消耗 3molNaOH |
分析 A.水杨酸结构不对称,有6种不同的H;
B.环己醇不含酚羟基;
C.水杨酸中含有酚羟基,可与溴发生取代反应;
D.1mol水杨酸环己酯水解生成水杨酸,只有酚羟基和羧基与氢氧化钠反应.
解答 解:A.水杨酸结构不对称,有6种不同的H,核磁共振氢谱有6个峰,故A错误;
B.环己醇不含酚羟基,与FeCl3溶液不反应,故B错误;
C.水杨酸中含有酚羟基,邻位和对位的氢原子可被取代,最多消耗2molBr2,故C正确;
D.1mol水杨酸环己酯水解产物含有1个羧基和1个酚羟基,可与碱反应,则1mol水杨酸环己酯在NaOH溶液中水解时,最多消耗2molNaOH,故D错误;
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握有机物官能团的性质以及结构特点,为解答该题的关键,注意审题.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:推断题

 ;
; ;
; ;
;
 )
) (其中两种)(任写两种)
(其中两种)(任写两种)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑦⑧⑧⑨⑩ | B. | ②④⑦⑨⑩ | C. | ③④⑦⑩ | D. | ③④⑤⑦⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 试剂 | 现象 |
| I | 饱和Ag2SO4溶液 | 产生白色沉淀 |
| II | 0.2mol•L-1CuCl2溶液 | 溶液变绿,继续滴加产生棕黄色沉淀 |
| III | 0.1mol•L-1Al2(SO4)3溶液 | 开始无明显变化,继续滴加产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉有氢气生成的溶液中可能大量存在:Ba2+、AlO2-、Cl- | |
| B. | 在含有NH3•H2O的溶液中可能大量共存的离子:Fe3+、HCO3-、NO3- | |
| C. | 亚硫酸的电离:H2SO3═HSO3-+H+ | |
| D. | 向NaHSO4溶液中加入Ba(OH)2溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 化学反应速率为“0.8 mol•L-1•s-1”所表示的意思是:时间为1 s时,某物质的浓度为0.8 mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应现象越明显,反应速率越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com