
| A. | 0.15mol | B. | 0.3mol | C. | 0.05mol | D. | 无法计算 |
科目:高中化学 来源: 题型:解答题
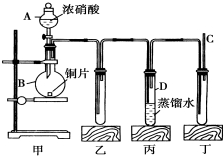 某学校化学学习小组为探究二氧化氮的性质,按如图所示装置进行实验.
某学校化学学习小组为探究二氧化氮的性质,按如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)=CH3OH(g)△H1=akJ/mol | 2.5 | 0.2 |
| ②H2(g)+CO2(g)=CO(g)+H2O(g)△H2=bkJ/mol | 1.0 | 2.3 |
| ③3H2(g)+CO2(g)=CH3OH(g)+H2O(g)△H3 | K3 | 4.6 |
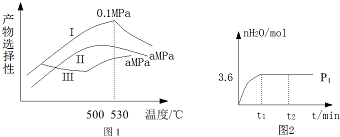
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
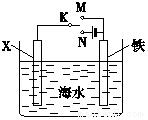 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | 蔗糖、酒精在水溶液或熔化时均不导电,所以它们是非电解质 | |
| C. | 铜、石墨均导电,所以它们是电解质 | |
| D. | NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中常用到的纯碱、酒精、食醋等,因都含有碳元素,所以都是有机物 | |
| B. | 有的钻戒中的钻石,是金刚石,因有正四面体的网状结构,所以硬度很大 | |
| C. | 由于啤酒中酒精含量不高,因此可以大量饮用,不会醉酒 | |
| D. | 我们用到的蔗糖、淀粉、纤维素,都是由C、H、O元素组成高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com