
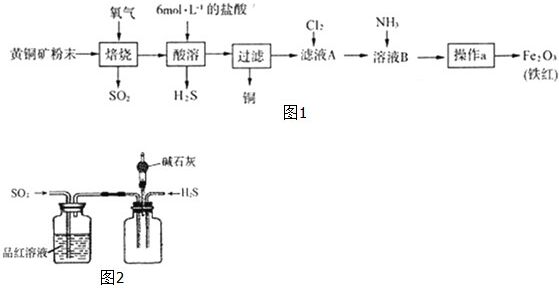
| ||
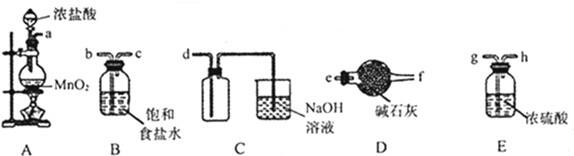
| ||
| ||
| ||
| 8g×368 |
| 20g×160 |


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O2 |
| B、向Na2CO3溶液中滴加HCl溶液,立即有气体产生CO32-+2H+═H2O+CO2↑ |
| C、Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物2Na2O2+2CO2═2Na2CO3+O2 |
| D、向NaHCO3溶液中逐滴加入澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
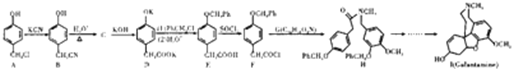
查看答案和解析>>
科目:高中化学 来源: 题型:
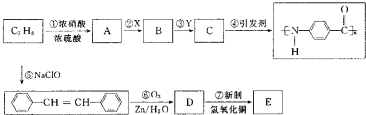
| O2,Zn/H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Br2/CCl4 |
| NaOH/H2O |
| O2Cu |
| O2/催化剂 |
| 一定条件 |
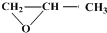 发生类似反应①的反应,试写出其中一种产物的结构简式
发生类似反应①的反应,试写出其中一种产物的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
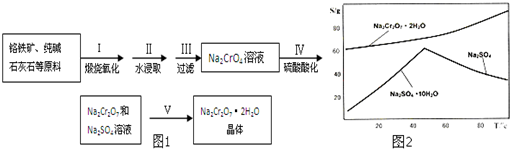
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、如遇到电线着火,应该先关掉电闸 |
| B、发现实验室中有大量的可燃性气体泄漏时,应立即开窗通风 |
| C、不慎将稀盐酸溅到眼睛里,应立即用大量水冲洗,边洗边眨眼睛 |
| D、不慎将少量浓碱溅到皮肤上,应立即用水冲洗,然后涂上3%的稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com