
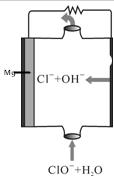
| A. | 电子由负极经电解质溶液移向正极 | |
| B. | ClO-参与的一极为正极 | |
| C. | 电池中镁为负极,发生氧化反应 | |
| D. | 放电过程中,溶液中Cl-的物质的量不变 |
分析 该燃料电池中电解质溶液呈碱性,Mg易失电子作负极,负极反应式为Mg-2e-=Mg 2+,正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,则电池反应式为Mg+ClO-+H2O=Mg(OH)2+Cl-,
A.电子从负极沿导线流向正极;
B.得电子化合价降低、发生还原反应的电极为正极;
C.失电子的电极发生氧化反应;
D.根据电池反应式确定氯离子浓度变化.
解答 解:该燃料电池中电解质溶液呈碱性,Mg易失电子作负极,负极反应式为Mg-2e-=Mg 2+,正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,则电池反应式为Mg+ClO-+H2O=Mg(OH)2+Cl-,
A.电子从负极沿导线流向正极,所以电子由负极Mg沿导线流向正极,故A错误;
B.得电子化合价降低、发生还原反应的电极为正极,该电池中次氯酸根离子得电子发生还原反应,所以ClO-参与的一极为正极,故B正确;
C.失电子的电极发生氧化反应,放电时,Mg失电子发生氧化反应,Mg为负极,故C正确;
D.根据电池反应式知,放电时生成氯离子,所以氯离子浓度增大,故D错误;
故选AD.
点评 本题考查化学电源新型电池,为高频考点,明确原电池中正负极判断方法、离子移动方向及电子移动分析是解本题关键,难点是电极反应式的书写,注意:放电时电子不进入电解质溶液,电解质溶液中阴阳离子定向移动形成电流,题目难度不大.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HI>HBr>HCl>HF | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:Cl-<Br-<I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③② | C. | ④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | e | f | h | |||||
| 3 | a | c | d | g | i | j | r | |
| 4 | b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: I:C(s)+H2O(g)?CO(g)+H2(g) K1 II:CO(g)+H2O(g)?CO2(g)+H2(g) K2 III:CaO(s)+CO2(g)?CaCO3(s) K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)=CO2(g)△H=-393.8kJ•mol-1 V:CaCO3(s)=CaO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com