
【题目】科学家对CO2的应用研究日新月异。
(1)科学家研制成功一种新型催化剂,能将CO2转变为甲烷。在常压、300℃,CO2与H2体积比为1︰4时在体积为V L的容器中反应,CO2转化率达90%。由图1可知升高温度,K将___(填“增大”“减小”或“不变”);300℃时,从反应开始,到达到平衡,以H2的浓度变化表示化学反应速率是____(用nA、tA、V表示)。


(2)CO2经催化加氢还可合成低碳烯烃有机物:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=Q kJ·mol1。在0.1MPa时,按n(CO2)︰n(H2)=1︰3投料,图2表示平衡时四种气态物质的物质的量(n)与温度(T)的关系。
C2H4(g)+4H2O(g) ΔH=Q kJ·mol1。在0.1MPa时,按n(CO2)︰n(H2)=1︰3投料,图2表示平衡时四种气态物质的物质的量(n)与温度(T)的关系。
①Q___0(填“>”“=”或“<”);
②曲线c表示的物质为____;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是___。
(3)已知CO2(g)+2CH3OH(g)![]() CH3OCOOCH3(g)+H2O(g)。在恒温容积可变的容器中加入1mol CO2、2mol CH3OH,CO2的转化率与反应时间如图3所示,在反应过程中加压,若t1时容器体积为1000mL,则t2时容器体积为_____mL。
CH3OCOOCH3(g)+H2O(g)。在恒温容积可变的容器中加入1mol CO2、2mol CH3OH,CO2的转化率与反应时间如图3所示,在反应过程中加压,若t1时容器体积为1000mL,则t2时容器体积为_____mL。
【答案】减小 ![]() mol·L1·min1 < C2H4 增大压强或增大氢气的浓度 25
mol·L1·min1 < C2H4 增大压强或增大氢气的浓度 25
【解析】
在利用图3时,从t1到t2,CO2的转化率由0.5变为0.8,我们仍需从起点开始建立三段式,如果从t1作为起点,则CO2的转化率不是0.3。
(1)由图1可知,升高温度,n(CH4)减小,平衡逆向移动,从而说明正反应为放热反应,K将减小;300℃时,以H2的浓度变化表示化学反应速率是![]() mol·L1·min1;
mol·L1·min1;
(2)①从图2 中可以看出,升高温度,n(H2)增大,说明平衡逆向移动,正反应为放热反应Q<0;
②平衡逆向路移动,n(H2)增大,n(CO2)增大,n(C2H4)减小,n(H2O)减小,再从变化量分析,n(H2O)为n(C2H4)的4倍,所以曲线c表示的物质为C2H4;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强或增大氢气的浓度;
(3) CO2(g)+2CH3OH(g)![]() CH3OCOOCH3(g)+H2O(g)
CH3OCOOCH3(g)+H2O(g)
起始量 1mol/L 2mol/L 0 0
变化量0.5mol/L 1mol/L 0.5mol/L 0.5mol/L
平衡量0.5mol/L 1mol/L 0.5mol/L 0.5mol/L
K=![]()
设加压后,容器的容积为V
CO2(g)+2CH3OH(g)![]() CH3OCOOCH3(g)+H2O(g)
CH3OCOOCH3(g)+H2O(g)
起始量 ![]() mol/L
mol/L ![]() mol/L 0 0
mol/L 0 0
变化量![]() mol/L
mol/L ![]() mol/L
mol/L ![]() mol/L
mol/L ![]() mol/L
mol/L
平衡量![]() mol/L
mol/L ![]() mol/L
mol/L ![]() mol/L
mol/L ![]() mol/L
mol/L
K= ,V=0.025L=25mL;
,V=0.025L=25mL;
答案为:25。


科目:高中化学 来源: 题型:
【题目】(1)在一定温度下,有下列反应发生:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),该反应的平衡常数表达式K=________。
(2)在配制FeCl3溶液时,加入少许浓盐酸,其目的是:_____________;不断加热FeCl3溶液,蒸干其水分并灼烧固体,最后得到的物质是________。
(3)已知:Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+![]() O2(g)===Fe2O3(s)的ΔH是____________________。
O2(g)===Fe2O3(s)的ΔH是____________________。
(4)Fe(OH)2在空气中短时间内可被氧化为Fe(OH)3,发生的反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,下列说法中错误的是________(填字母)。
A.该反应是能自发进行的反应
B.该反应是熵增加的反应
C.该反应是化合反应
D.该反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列说法正确的是
A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=a+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH<7
C.NH4Cl溶液的Kw大于NaCl溶液的Kw
D.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种重要的化工原料,通常用合成氨及合成硝酸的产物进行生产
(1)硝酸铵水溶液pH__________7(填“>”、“=”或“<”),其水溶液中各种离子浓度大小关系为___________
(2)已知合成氨的热化学方程式为:N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
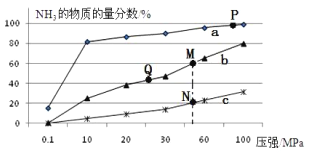
①曲线c对应的温度为___________ ℃
②下列说法中正确的是___________
A.增大氢气浓度,可促进平衡正向移动并能提高氮气的转化率
B.Q点对应的反应条件下,若加入适当的催化剂,可提高NH3在混合物中的物质的量分数
C.M、N两点的平衡常数大小关系为:M>N
D.M、N、Q三点反应速率的大小关系为:N>M>Q
E.为了尽可能多的得到NH3,应当选择P点对应的温度和压强作为生产条件
(3)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(4)柴油汽车尾气净化器通常用尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,请写出尿素与NO反应的化学方程式__________,当有1mol尿素完全反应时,转移电子的数目为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
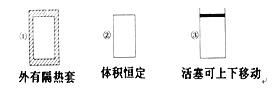
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同系物的说法中正确的是![]()
![]() C3H8和C5H12的关系一定是同系物
C3H8和C5H12的关系一定是同系物
![]() 分子组成相差一个或几个
分子组成相差一个或几个![]() 原子团的有机物是同系物
原子团的有机物是同系物
![]() 若烃中碳、氢元素的质量分数相同,它们不一定是同系物
若烃中碳、氢元素的质量分数相同,它们不一定是同系物
![]() 同系物的化学性质相似,同分异构体的化学性质一定不相似
同系物的化学性质相似,同分异构体的化学性质一定不相似
![]() 乙烯和聚乙烯互为同系物
乙烯和聚乙烯互为同系物
⑥![]() 与
与![]() 互为同系物
互为同系物
A. ②⑥ B. ③⑤ C. ①③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下两种不同浓度的NaOH溶液,c(H+)分别为1×10-13 mol/L和1×10-10 mol/L。将此两溶液等体积混合后,所得溶液中的c(H+)是( )
A.1×(10-14+10-10) mol/LB.![]() mol/L
mol/L
C.2×10-13 mol/LD.2×10-14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下反应:
①3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O | ②H++OH-=H2O |
③2Fe+3Cl2 | ④NaHCO3+NaOH=Na2CO3+H2O |
⑤CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 | ⑥NaClO+CO2+H2O=HClO+NaHCO3 |
⑦2Al+2NaOH+2H2O=2NaAlO2+3H2↑ | ⑧CO2+H2O=H2CO3 |
请回答:
(1)上述反应中有电子转移的是___(填序号),因此该类反应属于__反应。
(2)反应⑤的离子方程式是__。
(3)上述反应中属于复分解反应的是__(填序号)。复分解反应发生的条件是i.生成沉淀,ii.放出气体,iii.生成水等难电离物质,若要由反应印证i、ii、iii,则除了这几个反应外,请补充反应:_(写一个符合条件的化学方程式或离子方程式)。
(4)由反应①及所学知识判断:在该反应发生的条件下,NO3-、H+、Cu2+的氧化性由大到小的顺序是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com