
| A. | “钡餐”中使用的硫酸钡是弱电解质 | |
| B. | 太阳能电池板中的硅在周期表中处于金属与非金属的交界位置 | |
| C. | 常用的自来水消毒剂有Cl2和二氧化氯,两者都含极性键 | |
| D. | “滴水穿石”不涉及化学变化 |
分析 A.溶于水或熔融状态下完全电离的化合物为强电解质,反之部分电离为弱电解质,硫酸钡溶于水的部分完全电离,属于强电解质;
B.依据硅元素在周期表中的位置和一种结构特征分析判断;
C.不同非金属元素之间形成极性共价键,同种非金属元素之间形成非极性共价键;
D.化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化.
解答 解:A.硫酸钡溶于水的部分或熔融状态下完全电离,是强电解质,故A错误;
B.硅元素位于周期表中的第四主族,原子最外层四个电子,难失电子,难得电子,易形成共价键,处于金属非金属的分界线附近,故B正确;
C.二氧化氯中含有极性键,但氯气分子中只有含有非极性键,故C错误;
D.滴水穿石的过程中水中溶有的酸与石头中的碳酸钙反应有新物质二氧化碳等生成,包含了化学变化,故D错误;
故选B.
点评 本题考查强弱电解质判断、元素周期表应用、化学键、化学变化等,题目难度不大,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
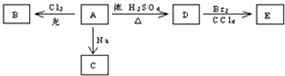
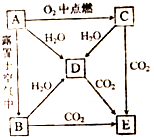 A、B、C、D、E五中物质中都含有钠元素,其互相转化关系如题:
A、B、C、D、E五中物质中都含有钠元素,其互相转化关系如题: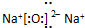 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
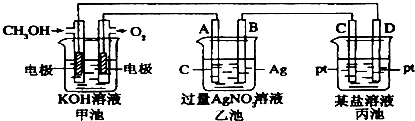
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
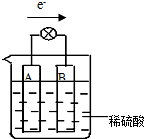 原电池是将化学能转变成电能的装置.某铜锌稀硫酸原电池中,电子由A极流出经导线流入B极,如图所示:
原电池是将化学能转变成电能的装置.某铜锌稀硫酸原电池中,电子由A极流出经导线流入B极,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化合物A(C4H10O)是一种有机溶剂.A可以发生如图变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如图变化: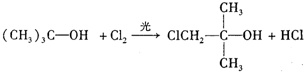 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com