
第题(分)银制器皿久置会失去光泽,这并不是仅仅由于氧气的作用,是被“流动的水和游荡的风”所侵蚀,经分析,银器失去光泽是由于其表面形成了X ,X可由以下三种方法除去,从而使银器恢复光泽。
① 将银器置于盛有苏打水的铝制器皿中煮沸
② 将银器在KSCN或NH4SCN溶液中放置几分钟
③ 将银器用A的乙醇-水溶液处理数分钟,X与A反应的物质的量比为1:8,A是 NH4SCN的同分异构体,所有原子均只有一种化学环境。
试回答如下问题:
⑴ 给出X 和 A的化学式,并写出生成X的化学方程式
⑵ 写出除去X的三种方法的化学反应方程式
⑶ 计算X 在水中的溶解度,
已知Ksp,X = 6.3×10-50, X的阴离子对应的酸Ka1=9.5×10-8, Ka2=1.0×10-14
⑷ 试判断X在浓度相同的HNO3与HCl中的溶解性大小,说明你的理由
⑴ X :Ag2S, A:SC(NH2)2
4Ag + 2H2S + O2 = 2Ag2S + 2H2O. (各1分 共3分)
⑵ ① 2Al +3Ag2S+6H2O+3 Na2CO3=2Al(OH)3 +6Ag+ 3NaHS +3NaHCO3
或 负极: Al -3e- = Al3+
正极: 3Ag2S + 6e-= 6Ag+3S2-
② Ag2S + 4SCN- = 2[Ag(SCN)2]- + S2-,
③ Ag2S + 8SC(NH2)2 = 2Ag[SC(NH2)2]4+ + S2-. (各1分 共3分)
⑶ Ag2S ![]() 2Ag+ + S2-,
2Ag+ + S2-,
S2- + H2O ![]() HS- + OH- ,HS- + H2O
HS- + OH- ,HS- + H2O ![]() H2S + OH-.
H2S + OH-.
Cs = [H2S] + [HS-] + [S2-], [Ag+] = 2Cs,
[S2-] = a Cs, Ag2S ksp极小,[H+]可视为10—7mol/L (1分)
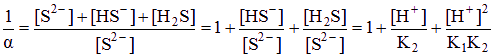
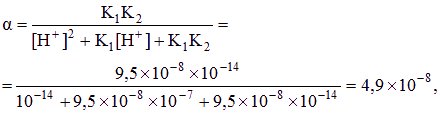
[Ag+] = 2Cs,
KSp(Ag2S) = [Ag+]2 ?? [S2-] = 4aCS3,
|
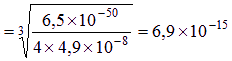 mol/L 或1.7?? 10—12g/L;1.7?? 10—13g/100g水(2分)
mol/L 或1.7?? 10—12g/L;1.7?? 10—13g/100g水(2分) ⑷ HNO3中的溶解性更好 (1分)
3Ag2S + 8HNO3 = 6AgNO3 + 2NO + 3S + 4H2O (1分)
(生成物写成H2SO4也对)
⑴ 硫化物和硫化氢能使银器变黑,由于空气和水中含有硫化氢、硫化物,所以银器失失去光泽。X为Ag2S。
A是 NH4SCN的同分异构体,且所有原子均只有一种化学环境,所以A的分子结构如下:
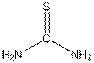 。
。
⑵ 在除去Ag2S的三种方法中,应用到了不同的化学原理使难溶物Ag2S溶解:
①是利用了原电池反应,即铝做负极,Al+3H2O+3CO32--3e==Al(OH)3↓+3HCO3-,Ag2S为正极,得电子,被还原:3Ag2S + 6e-= 6Ag+3S2-
②利用配位反应,除去Ag2S,即形成可溶性的Ag(SCN)2-,除去Ag2S。
③也是利用配位反应促进Ag2S的溶解,即发生反应Ag2S + 8SC(NH2)2 = 2Ag[SC(NH2)2]4+ + S2-,从而除去Ag2S。
⑶ 从Ag2S的溶解平衡Ag2S ![]() 2Ag+ + S2-来看,由于S2-的共轭酸是弱电解质,所以溶液的酸度会影响到Ag2S的溶解性,即发生所谓的酸效应:溶液的酸度越大,[S2-]就越小,Ag2S的溶解度就越大,反之越小。在Ag2S的水溶液中,由于[S2-]很小,可以近似认为溶液呈中性,即[H+]≈1.0×10-7 (mol/L)。利用分布分数,可求得[S2-]=c(S2-)·δ(S2-),其中c(S2-)是S2-的分析浓度,也为Ag2S溶解度S,c(S2-)=2s,δ(S2-)是S2-的分布分数,可根据公式δ(S2-)=
2Ag+ + S2-来看,由于S2-的共轭酸是弱电解质,所以溶液的酸度会影响到Ag2S的溶解性,即发生所谓的酸效应:溶液的酸度越大,[S2-]就越小,Ag2S的溶解度就越大,反之越小。在Ag2S的水溶液中,由于[S2-]很小,可以近似认为溶液呈中性,即[H+]≈1.0×10-7 (mol/L)。利用分布分数,可求得[S2-]=c(S2-)·δ(S2-),其中c(S2-)是S2-的分析浓度,也为Ag2S溶解度S,c(S2-)=2s,δ(S2-)是S2-的分布分数,可根据公式δ(S2-)=![]() 求得。由于Ksp=[Ag+]2[S2-]= 4c(S2-)3·δ(S2-),最后通过解方程可求得Ag2S的溶解度。
求得。由于Ksp=[Ag+]2[S2-]= 4c(S2-)3·δ(S2-),最后通过解方程可求得Ag2S的溶解度。
⑷ 同样从Ag2S的溶解平衡过程来看,HNO3的强氧化性能使溶液中[S2-]减少,促进平衡向难溶物溶解的方向移动。
提示:综上所述,难溶物溶解的方法有:发生明显酸效应、生成配合物、发生氧化还原反应、通过沉淀转化等。


 阅读快车系列答案
阅读快车系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com