
【题目】某新型锂空气二次电池放电情况如图所示,关于该电池的叙述正确的是
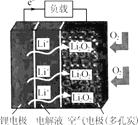
A.电解液应选择可传递Li+的水溶液
B.充电时,应将锂电极与电源正极相连
C.放电时,空气电极上发生的电极反应为 2Li++O2+2e-=Li2O2
D.充电时,若电路中转移0.5mol电子,空气电极的质量将减少3.5g
【答案】C
【解析】
在锂空气电池中,锂作负极,电极反应式为Li-e-=Li+,以空气中的氧气作为正极反应物,正极上是氧气得电子的还原反应,反应为2Li++O2+2e-=Li2O2,据此解答。
A.Li易与水反应,所以电解液不能选择可传递Li+的水溶液,A错误;
B.充电时,电池的负极连接电源的负极,所以应将锂电极与电源负极相连,B错误;
C.放电时,空气中的氧气作为正极反应物,正极上是氧气得电子的还原反应,反应为2Li++O2+2e-=Li2O2,C正确;
D.充电时,空气电极反应为Li2O2-2e-=2Li++O2,可见每转移2mol电子,空气电极的质量减少46g,若电路中转移0.5 mol电子,空气电极的质量将减少46g÷4=11.5g,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】实验:①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液;②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色;④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。下列说法中,不正确的是( )
A. 将①中所得浊液过滤,所得滤液中含少量Mg2+
B. 浊液中存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
C. 实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用图示装置制备高铁酸钾(K2FeO4)并探究其性质。已知:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。制取实验完成后,取C中紫色溶液,加入稀盐酸,产生气体。下列说法不正确的是

A.B瓶应盛放饱和食盐水除去混有的HCl
B.C瓶中KOH过量更有利于高铁酸钾的生成
C.加盐酸产生气体可说明氧化性:K2FeO4>Cl2
D.高铁酸钾是集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等八大特点为一体的优良的水处理剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛经催化加氢可制备1丁醇。为提纯含少量正丁醛杂质的1丁醇,现设计如下路线:
![]()
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1丁醇互溶;③1丁醇的沸点是118℃。
则操作1~4分别是______、_______、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离常数如下表:

下列叙述正确的是
A. 氢氟酸与NaClO溶液混合能够发生反应:HF+NaClO=HClO+NaF
B. 物质的量浓度相同的①NaF②Na2CO3③NaClO三种溶液的pH:③>②>①
C. Na2CO3溶液不能与次氯酸发生反应
D. 少量CO2通入NaClO溶液中的离子反应:CO2+H2O+2ClO-= CO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。现以Al—H2O2电池电解尿素CO(NH2)2的碱性溶液制备H2,下列说法不正确的是( )
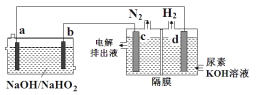
A.电解过程中,电子的流向由a→d→c→b
B.电池的正极反应为:HO2-+2e-+H2O=3OH-
C.电解时,消耗5.4gAl,则产生标况下2.24L N2
D.电极c是阳极,且反应后该电极区pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO3·H2O2),俗名固体双氧水,具有Na2CO3和H2O2双重性质,可用作无毒漂白剂和供氧剂。一种利用双氧水和纯碱在稳定剂作用下制备过碳酸钠的工艺流稳定程如下图。已知:2Na2CO3+3H2O2![]() 2Na2CO3·3H2O2
2Na2CO3·3H2O2

下列说法不正确的是
A.FeCl3溶液可加速过碳酸钠的失效
B.加入NaCl的作用是降低2Na2CO3·3H2O2的溶解度,以析出更多晶体
C.生产过碳酸钠的流程中遗漏了晶体的洗涤一步,导致产品纯度降低
D.该生产流程中可循环使用的物质是CO2和NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2。符合上述转化关系的A、C可能是
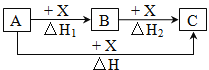
①Fe、FeCl3②C、CO2③AlCl3、NaAlO2④NaOH、NaHCO3⑤S、SO3⑥Na2CO3、CO2
A.只有②③④⑥B.除①外C.除⑤外D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com