
| A. | 分子中3个碳原子在同一直线 | B. | 分子中所有原子在同一平面上 | ||
| C. | 与氯化氢加成只生成一种产物 | D. | 能发生加聚反应 |
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤经处理变为气体燃料的过程属于物理变化 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| C. | 乙烷和乙醇均能发生取代反应 | |
| D. | 乙酸乙酯和植物油均可水解生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②④⑤ | C. | ①②④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
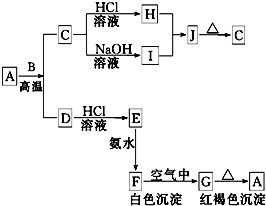 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
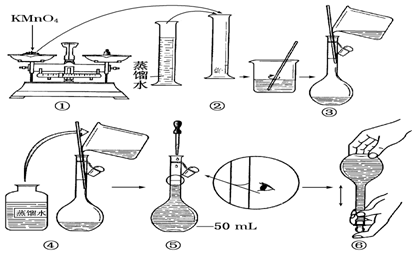
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O中含NA个质子 | |
| B. | 1 L 1 mol•L-1的CuSO4溶液中含NA个Cu2+ | |
| C. | 常温常压下,2.24 L Cl2中含0.2NA个氯原子 | |
| D. | 0.5 mol Al与足量NaOH溶液充分反应,转移的电子数目为1.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com