
分析 (1)据方程式2A1+2NaOH+2H2O═2NaAlO2+3H2↑要想生成H2最多,则消耗铝最多来分析;
(2)分不同情况讨论金属铝有没有完全反应,并根据得失电子守恒计算.
解答 解:(1)设Na为xmol,则Al为(1-x)mol
2Na+2H2O=2NaOH+H2↑①
2 2 1
x x $\frac{1}{2}x$
∵由方程式②可知消耗铝的物质的量越多生成H2的量越多,要想消耗铝最多,则反应①生成的NaOH需完全反应
∴2A1+2NaOH+2H2O═2NaAlO2+3H2↑②
2 2 3
x x 3x
则(1-x)=x,解得x=0.5
∴n(Na)=0.5mol,n(Al)=0.5mol
n(Na):n(Al)=0.5:0.5=1:1,故答案为:1:1;
(2)
情况一、Na与Al完全反应时,
n(H2)=$\frac{V}{Vm}$=$\frac{13.44}{22.4}$=0.6mol则得到电子数目为n(e-)=1.2mol
设参加反应的金属Naxmol,Alymol,则失去电子数为n(e-)=x+3y
根据得失电子守恒得:x+3y=1.2①
x+y=1②
联立①②解得x=0.9,y=0.1,n(Na):n(Al)=0.9:0.1=9:1
情况二、Al未完全反应时,设Naxmol,Al(1-x)mol.
2Na+2H2O=2NaOH+H2↑①
2 2 1
x x $\frac{1}{2}x$
2A1+2NaOH+2H2O═2NaAlO2+3H2↑②
2 2 3
x x $\frac{3}{2}$ x
n(H2)=$\frac{1}{2}$x+$\frac{3}{2}$x=o.6,解得x=0.3mol即n(Na)=0.3mol
∴n(Al)=1-0.3=0.7mol则n(Na):n(Al)=3:7
故答案为:9:1(或3:7).
点评 金属铝要想反应必须要金属钠反应生成氢氧化钠,故题目二要从两方面考虑,以及正确书写方程式也是解题的关键.


科目:高中化学 来源: 题型:填空题
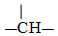 、
、 等结合而成的.试写出同时满足下列条件的烷烃的结构简式:
等结合而成的.试写出同时满足下列条件的烷烃的结构简式: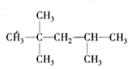
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知25℃和101kPa时
(1)已知25℃和101kPa时| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.50 | n1 | 0.34 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
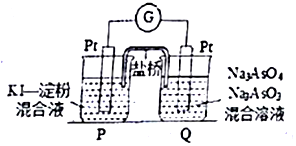 砷(As)是第四周期第VA族元素,用化学用语回答问题.
砷(As)是第四周期第VA族元素,用化学用语回答问题. ,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)
,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向KBrO2溶液中加入少量苯,然后通入少量Cl2 | 有机层呈橙色 | 氧化性:Cl2>KBrO2 |
| B | 向KNO3和KOH混合溶液中加入铝粉并加热,将湿润的红色石蕊试纸放在试管口 | 试纸变为蓝色 | NO${\;}_{3}^{-}$被还原为NH3 |
| C | 向0.1mol•L-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 将0.1mol•L-1的MgSO4溶液滴入到NaOH溶液中至不再有沉淀产生,再滴加0.1mol•L-1的CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com