
【题目】以粉煤灰(主要含Al2O3、SiO2,还有少量的Fe2O3)为原料制取Al2O3的流程如下:
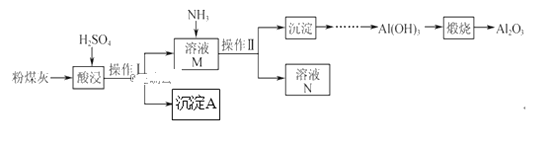
(1)操作Ⅰ的名称是__。
(2)用H2SO4“酸浸”时的离子方程式为__(任写一个)。
(3)简述如何检验酸浸后溶液中是否有Fe3+__。
(4)“煅烧”时的化学方程式为__。
(5)沉淀A与氢氟酸反应的化学方程式为__。
【答案】过滤 Fe2O3+6H+=2Fe3++3H2O(或Al2O3+6H+=Al3++3H2O任写一个) 取适量该溶液于试管中,加入KSCN,若变红则有Fe3+ 2Al(OH)3![]() Al2O3+3H2O SiO2+4HF=SiF4↑+2H2O
Al2O3+3H2O SiO2+4HF=SiF4↑+2H2O
【解析】
粉煤灰(主要含Al2O3、SiO2, 还有少量的Fe2O3)和稀硫酸混合,发生反应Al2O3+3H2SO4═Al2(SO4)3+3H2O,Fe2O3+3H2SO4═Fe 2(SO4)3+3H2O,SiO2和稀硫酸不反应,过滤溶液得滤渣Ⅰ为SiO2; 根据Fe3+遇KSCN溶液变红色检验溶液中是否有Fe3+;Al(OH)3加热分解为Al2O3和水;SiO2与氢氟酸反应生成SiF4和水。
(1)操作Ⅰ实现了固体SiO2和溶液的分离,操作Ⅰ的名称是过滤。
(2)用H2SO4“酸浸”时Al2O3、Fe2O3与硫酸反应,反应的离子方程式分别为Al2O3+6H+=Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O。
(3)Fe3+遇KSCN溶液变红色,检验溶液中是否有Fe3+的方法是:取适量该溶液于试管中,加入KSCN,若变红则有Fe3+。
(4)“煅烧”时Al(OH)3分解为Al2O3和水,化学方程式为2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。
(5)沉淀A是SiO2,SiO2与氢氟酸反应生成SiF4和水,化学方程式为SiO2+4HF=SiF4↑+2H2O。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
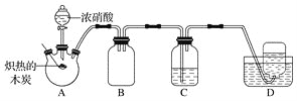
【题目】某化学小组采用如图所示装置,对浓硝酸与木炭的反应进行探究(已知:4HNO3![]() 4NO2↑+O2↑+2H2O)。
4NO2↑+O2↑+2H2O)。
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至炽热状态,伸入三颈烧瓶中,生成的气体的颜色为__,产生该气体的反应的化学方程式是__。
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为__(填化学式)。
(3)装置B的作用是__。
(4)装置D中收集到了无色气体,有同学认为是NO,还有同学认为是O2。
①下列对该气体的检验方法合适的是__(填字母)。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶内收集到的无色气体是氧气,则氧气的来源是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空。
(1)49 g 的H2SO4的物质的量为______mol。
(2)标准状况下,5.1g氨气的体积是__________L。
(3)将53克Na2CO3 溶解在水中,配成500mL溶液,所得溶液中Na+物质的量浓度是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学能与其他能量相互转化的说法正确的是( )
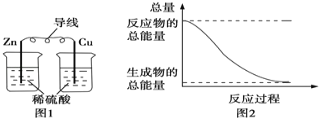
A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定硫酸铜晶体(CuSO4·xH2O)结晶水含量的实验流程如下:
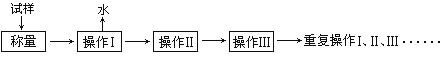
请回答:
(1)以下是实验中可能用到的几种仪器,请在图下方横线上写出仪器名称。
|
|
|
|
a. 电子天平 | b. ___________ | c. ____________ | d. 酒精喷灯 |
①“操作I”是灼烧硫酸铜晶体,将用到上述________(填序号)仪器;
②“操作Ⅱ”是____________,必须在________(填序号)中进行,否则将造成实验测定结果_____________(填“偏高”、“偏低”或“正确”)。
(2) “重复操作Ⅰ、Ⅱ、Ⅲ”,称为恒重操作。判断达到恒重的依据是____________________________________________;进行恒重操作的目的是____________________________________________。
(3)某学生实验后得到下表数据:
加热前质量 | 加热后质量 | |
m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
5.4 g | 7.9 g | 6.9 g |
① 由此该学生计算得出该硫酸铜晶体中结晶水x的值为________________(精确到0.1)。
② 指出该同学实验操作或数据处理中存在的主要问题____________(至少写2点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及碳氧化物是许多城市大气污染的主要污染物。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1=393.5kJ·mol1
2C(s)+O2(g)=2CO(g) △H2=221.0kJ·mol1
N2(g)+O2(g)=2NO(g) △H3=+180.5kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式___。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
下列能说明该反应已经达到平衡状态的是___(填字母代号)。
A.![]() 比值不变
比值不变
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。
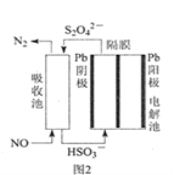
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式___。用离子方程式表示吸收池中除去NO的原理___。
(4)T1温度时在容积为2L的恒容密闭容器中发生反应:2CO(g)+O2(g)![]() 2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(CO)/mol | 2 | 1.2 | 0.8 | 0.4 | 0.4 | 0.4 |
n(O2)/mol | 1.2 | 0.8 | 0.6 | 0.4 | 0.4 | 0.4 |
①T1温度时![]() =___L/mol。
=___L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__T1(填“>”、“<”或“=")。
II.“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题。在0.1MPa、Ru/TiO2催化下,将一定量的H2和CO2置于恒容密闭容器中发生反应X:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
(5)温度为T时,向10L密闭容器中充入5molH2和CO2的混合气体,此时容器内压强为5P,两种气体的平衡转化率ɑ与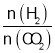 的关系如图所示:
的关系如图所示:
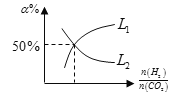
①图中CO2的平衡转化率可用表示___(L1或L2)
②该温度下,反应X的平衡常数Kp=___。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯具有特殊香气。可溶于乙醇或乙醚,不溶于水,其结构简式如图所示:
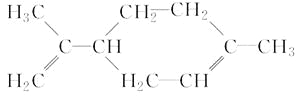
有关柠檬烯的说法正确的是( )
A.柠檬烯的分子式为C10H16,能使溴的四氯化碳溶液褪色
B.柠檬烯分子为非极性分子
C.柠檬烯分子中所有碳原子处于同一个平面上
D.柠檬烯能与酸性高锰酸钾溶液发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,A是氯气的发生装置,B、C是净化气体的装置,B装置中装有饱和食盐水,D中装铁丝网;反应后E的底部有棕色固体聚集;F是碱液用于吸收多余气体的装置。
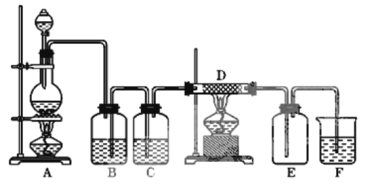
(1)上述装置中有一处错误,请指出是___处(用字母表示)。
(2)B装置的作用是___,C装置中需要加入___。
(3)写出A中发生反应的化学方程式___。
(4)如果A中产生氯气2.24L(标准状况),则被氧化的HCl的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量比为14 :15的N2和NO混合,则混合气体中氮原子和氧原子的个数比为________
(2)同温同压下,质量相同的五种气体:①CO2 ②H2 ③O2 ④CH4 ⑤SO2所占的体积由大到小的顺序是(填序号,下同)_________________;
(3)已知19g某二价金属的氯化物RCl2中含有0.4mol的Cl-离子,则R的相对原子质量为______________________ ;
(4)在Al2(SO4)3和MgSO4组成的混合物中,Al3+与Mg2+的物质的量之比为2∶1,则在含有2mol SO42-的混合物中,MgSO4的质量是________________克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com