
| A. | 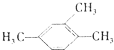 1,3,4-三甲苯 1,3,4-三甲苯 | B. | Cl-CH2-CH=CH2 3-氯-1-丙烯 | ||
| C. | 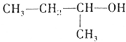 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 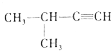 2-甲基-3-丁炔 2-甲基-3-丁炔 |
分析 A、苯的同系物在命名时,从简单的侧链开始按顺时针或逆时针给主链上的碳原子进行编号,使侧链的位次和最小;
B、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置;
C、醇命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置;
D、炔烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置.
解答 解:A、苯的同系物在命名时,从简单的侧链开始按顺时针或逆时针给主链上的碳原子进行编号,使侧链的位次和最小,故甲基在1号、2号和4号碳原子上,故名称为1,2,4-三甲基苯,故A错误;
B、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置,故碳碳双键在1号和2号碳原子间,在3号碳原子上有一个氯原子,故名称为3-氯-1-丙烯,故B正确;
C、醇命名时,要选含官能团的最长的碳链为主链,故主链上有4个碳原子,称为丁醇,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置,故羟基在2号碳原子上,称为2-丁醇,故C错误;
D、炔烃命名时,要选含官能团的最长的碳链为主链,故主链上有4个碳原子,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置,故碳碳三键在1号和2号碳原子间,在3号碳原子上有一个甲基,故名称为3-甲基-1-丁炔,故D错误.
故选B.
点评 本题考查了有机物的命名,应注意的是含官能团的有机物在命名时,选主链和编号3应以官能团为考虑对象.


科目:高中化学 来源: 题型:解答题
| 1min | 2min | 5min | 15min | 20min | |
| 3mol•L-1HCl | 少量气泡 | 较多气泡 | 打量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol•L-1H2SO4 | 均无明显现象(只有少量气泡) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 | |
| C. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用,迅速混合后测出初始温度,用环形玻璃搅拌棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 | |
| D. | 将含有少量氯化钾的硝酸钾放入烧杯中,加水溶解并加热、搅拌,当溶液表面出现一层晶膜时停止加热,冷却结晶,过滤即可得到大量硝酸钾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳碳双键不可旋转所以烯烃一定有顺反异构 | |
| B. | 由乙烯、乙炔的结构特点可推知CH3-CH=C(CH3)-C≡C-CH3分子中所有的碳原子共面 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有乙烯分子中类似的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
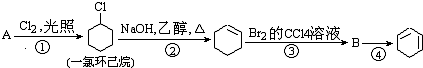
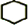 ,名称是环己烷.
,名称是环己烷. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$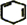 +2NaBr+2H2O.
+2NaBr+2H2O.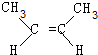 、
、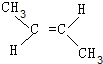 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCO(g)完全燃烧生成CO2(g)放出热量283J | |
| B. | 1molCO(g)完全燃烧比1molC(s)完全燃烧放出的热量多 | |
| C. | 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2 (g)△H<-452kJ/mol | |
| D. | 当Na2O2(s)与CO2(g)反应生成Na2CO3(s)和O2 (g)放出452kJ热量时,转移的电子数为2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com