
| A. | 将NH3通入AgN03溶液中,再加几滴葡萄糖溶液,加热后有银镜产生,证明葡萄糖有氧化性 | |
| B. | 配制Fe(N03)2溶液时,向Fe(N03)2溶液中加几滴稀硫酸,以防止Fe(N03)2发生水解 | |
| C. | 向NaI溶液中加入少量CCl4振荡,未见蓝色,说明NaI没有变质 | |
| D. | 剪取一小块铝箔,投入到NaOH溶液中,观察到在被剪断处先产生气体,说明铝在空气中易被氧化 |
分析 A.葡萄糖具有还原性,能被银氨溶液氧化;
B.酸性条件下,亚铁离子能被硝酸根离子氧化;
C.四氯化碳能萃取碘,碘的四氯化碳溶液呈紫色;
D.氧化铝和NaOH反应没有气体生成,铝和氢氧化钠溶液反应生成氢气.
解答 解:A.葡萄糖具有还原性,能被银氨溶液氧化生成银单质,所以葡萄糖和银氨溶液反应时体现还原性,故A错误;
B.酸性条件下,亚铁离子能被硝酸根离子氧化生成铁离子,且硫酸的加入引进新的杂质,应该加入Fe粉,故B错误;
C.四氯化碳能萃取碘,碘的四氯化碳溶液呈紫色,碘离子如果被氧化生成碘单质,则碘的四氯化碳溶液应该呈紫色而不是蓝色,故C错误;
D.氧化铝和NaOH反应没有气体生成,铝和氢氧化钠溶液反应生成氢气,剪取一小块铝箔,投入到NaOH溶液中,观察到在被剪断处先产生气体,说明铝在空气中易被氧化,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质性质、盐类水解,明确实验原理及物质性质是解本题关键,易错选项是B,注意酸性条件下硝酸根离子的氧化性,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
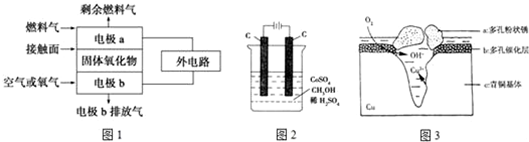
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③能与水在一定条件下反应生成C
③能与水在一定条件下反应生成C
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
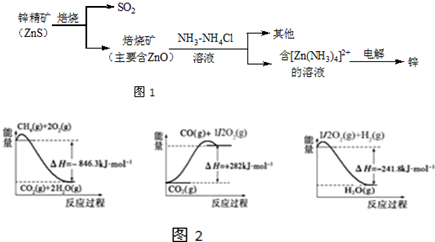
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池属于二次电池 | |
| B. | 锂离子电池是一种一次性电池 | |
| C. | 氢氧燃料电池可把化学能转化为电能 | |
| D. | 镍镉电池中,Cd为负极,NiO(OH)为正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com