
| ��ѧ�� | H-H | N-H | N��N |
| ����kJ/mol | 436 | 391 | 945 |
���� ��1�������Ȼ�ѧ����ʽ����д������֪����ѧ�������뷴Ӧ�ȳ����ȣ���ע��������ʵľۼ�״̬��
��2�����ݡ�H=��Ӧ����ܺ�-��������ܺ����㣻
��3�������ȸ��ݷ�Ӧ�����������д��ѧ����ʽ�����ݸ�˹���ɼ��㷴Ӧ���ʱ䣬�������Ȼ�ѧ����ʽ����д��������д�Ȼ�ѧ����ʽ��
��� �⣺��1��5gCH3OH��������ȼ������CO2��Һ̬ˮ���ų�113.5kJ������64g��2molCH3OH��������ȼ������CO2��Һ̬ˮ���ų�1452.8kJ���������Ȼ�ѧ����ʽΪ��2CH3OH��g��+3O2��g���T2CO2��g��+4H2O��l����H=-1452.8KJ��
�ʴ�Ϊ��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l����H=-1452.8kJ/mol��
��2����H=��Ӧ����ܺ�-��������ܺ�=945KJ/mol+3��436KJ/mol-6��391KJ/mol=-93KJ/mol����a=-93��
�ʴ�Ϊ��-93��
��3����֪����C ��s��ʯī��+O2��g��=CO2��g����H1=-393.5kJ•mol-1��
��2H2��g��+O2��g��=2H2O ��l����H2=-571.6kJ•mol-1��
��2C2H2��g��+5O2��g���T4CO2��g��+2H2O ��l����H2=-2599kJ•mol-1��
2C ��s��ʯī��+H2��g��=C2H2��g���ķ�Ӧ���Ը��ݢ١�2+�ڡ�$\frac{1}{2}$-�ۡ�$\frac{1}{2}$�õ���
���Է�Ӧ�ʱ��H=2����-393.5kJ•mol-1��+��-571.6kJ•mol-1����$\frac{1}{2}$-��-2599kJ•mol-1����$\frac{1}{2}$=+226.7kJ•mol-1��
�ʴ�Ϊ��2C ��s��ʯī��+H2��g��=C2H2��g����H=+226.7 kJ/mol��
���� ���⿼�����Ȼ�ѧ����ʽ��д����Ӧ�ȼ��㣬��ȷ���ü��������ʱ�ķ��������Ĵ�������Ӧ�ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������Cu2OΪ1.44 g | |
| B�� | ��������������Ϊ0.14 mol | |
| C�� | ������0.5 moI/L����140 mL��Cu2O��Ӧ | |
| D�� | ת�Ƶĵ�������Ϊ0.06 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
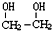 ����һ����Ҫ�Ļ���ԭ�ϣ�
����һ����Ҫ�Ļ���ԭ�ϣ� ��g����H=a kJ/mol
��g����H=a kJ/mol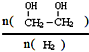 ����Ĵ�ʩ�н��¡���ѹ������CO��Ũ�Ȼ�ʱ���Ҷ����ӻ�����з��������д������
����Ĵ�ʩ�н��¡���ѹ������CO��Ũ�Ȼ�ʱ���Ҷ����ӻ�����з��������д�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
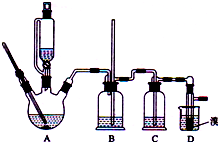 ʵ�����Ʊ�1��2-��������ķ�Ӧԭ�����£�
ʵ�����Ʊ�1��2-��������ķ�Ӧԭ�����£�| �Ҵ� | 1��2-�������� | ���� | |
| ״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
| �ܶ�/g•cm-3 | 0.79 | 2.2 | 0.71 |
| �е�/�� | 78.5 | 132 | 34.6 |
| �۵�/�� | һl30 | 9 | -1l6 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com