
| A. | 1:3 | B. | 3:1 | C. | 1:4 | D. | 1:1 |
分析 先根据方程式求出H2和C3H8的燃烧热,设H2的物质的量为nmol,则C3H8的物质的量为5mol-n,根据放出的热量列方程式解答.
解答 解:设混合气中H2的物质的量为n,则C3H8的物质的量为5mol-n,由热化学方程式可知1mol氢气燃烧放出的热量为285.8kJ,
根据题意,列方程为:285.8kJ/mol×n+2220.0kJ/mol×(5mol-n)=3847kJ,
解得:n=3.75mol,
C3H8的物质的量为5mol-3.75mol=1.25mol,
所以混合气体中H2与C3H8的体积比即物质的量之比为3.75 mol:1.25 mol=3:1,
故选:B.
点评 本题以热化学反应方程式为载体考查根据方程式计算,侧重考查学生分析问题、计算能力,熟练掌握基本公式并灵活运用,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠在火焰上灼烧时使火焰呈黄色,是因为氯化钠发生了分解反应 | |
| B. | 用焰色反应可以鉴别KCl和KNO3 | |
| C. | 连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则肯定有K元素,可能有Na元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
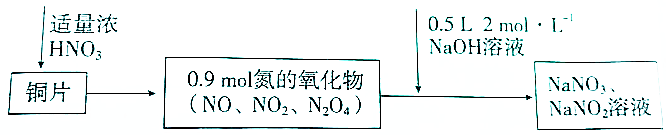
| A. | 若铜片为51.2g.则生成0.2molNaNO3 | |
| B. | 常温下,Cu遇浓硝酸发生钝化.不可能发生上述反应 | |
| C. | 标准状况下收集的氮氧化物为20.16L | |
| D. | 反应过程中生成的Cu(N03)2既是氧化产物,也是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 30% | C. | 45% | D. | 55% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有适量KBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有适量NaI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加KSCN; 向B试管中滴加淀粉: | ①若A变红色, B不变色则假设1成立 ②若A不变色, B变蓝色则假设2成立 ③若A变红色, B变蓝色则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热反应,化学方程式为2Fe+Al2O3═2Al+Fe2O3 | |
| B. | 原电池是电能转化为化学能的装置 | |
| C. | 绿色植物的光合作用则实现了光能向化学能的转化 | |
| D. | 氯碱工业用电解饱和食盐水来制备氯气和火碱就是将化学能转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com