
| 反应时间/s | 0 | 3 | 6 | 12 | 24 |
| n(CO2)/mol | 0 | 0.6 | 0.96 | 1.5 | 1.5 |
| A. | 反应在0~3s内的平均速率v(H2O)=0.12mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(CO2)=0.76mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,若起始时向容器中充入4.0molH2O和2.0molCO2、2.0molH2,与原平衡相比,达到平衡时,容器内压强增大 | |
| D. | 在T温度下,起始时向容器中充入2.0molH2O、1.0molCO2和1.0molH2,达到平衡时,CO2的转化率等于25% |
分析 A.根据v=$\frac{△c}{△t}$计算v(CO2),再利用速率之比等于其化学计量数之比计算v(H2O);
B.由表中数据可知,24s时处于平衡状态,CO2的浓度为$\frac{1.5mol}{2L}$=0.75mol/L,若保持其他条件不变,降低温度,达到新平衡时测得c(CO2)=0.76mol•L-1>原平衡的0.75mol/L,说明平衡向正反应方向移动;
C.反应前后气体总物质的量不变,故两种情况下平衡时气体总物质的量相等,恒温恒容下,容器内压强之比等于气体总物质的量之比;
D.利用三段式计算原平衡时各组分的物质的量,反应前后气体总物质的量不变,用物质的量代替浓度代入K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c(H2O)}$计算平衡常数,设参加反应的CO2为n mol,表示出平衡时各组分物质的量,代入平衡常数列方程计算解答.
解答 解:A.0~3s内v(CO2)=$\frac{\frac{0.6mol}{2L}}{3s}$=0.1mol•L-1•s-1,速率之比等于其化学计量数之比,则v(H2O)=v(CO2)=0.1mol•L-1•s-1,故A错误;
B.由表中数据可知,24s时处于平衡状态,CO2的浓度为$\frac{1.5mol}{2L}$=0.75mol/L,若保持其他条件不变,降低温度,达到新平衡时测得c(CO2)=0.76mol•L-1>原平衡的0.75mol/L,说明平衡向正反应方向移动,而降低温度平衡向放热反应进行,故正反应为放热反应,即△H<0,故B正确;
C.反应前后气体总物质的量不变,故两种情况下平衡时气体总物质的量相等,恒温恒容下,容器内压强之比等于气体总物质的量之比,故两种情况下的平衡状态容器内压强相等,故C错误;
D.原平衡在12s反应到达平衡,则:
CO(g)+H2O?CO2(g)+H2(g)
开始(mol):2 6 0 0
转化(mol):1.5 1.5 1.5 1.5
平衡(mol):0.5 4.5 1.5 1.5
反应前后气体总物质的量不变,用物质的量代替浓度计计算平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c(H2O)}$=$\frac{1.5×1.5}{0.5×4.5}$=1,
设参加反应的CO2为n mol,则:
CO(g)+H2O?CO2(g)+H2(g)
开始(mol):0 2 1 1
转化(mol):n n n n
平衡(mol):n 2+n 1-n 1-n
故$\frac{(1-n)×(1-n)}{n×(2+n)}$=1,解得n=0.25,达到平衡时,CO2的转化率为$\frac{0.25mol}{1mol}$×100%=25%,故D正确,
故选:BD.
点评 本题考查化学平衡影响因素、反应速率计算、化学平衡有关计算、化学平衡常数应用,注意对平衡常数的理解与应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$溶液$\stackrel{硝酸钡溶液}{→}$白色沉淀$\stackrel{稀硝酸}{→}$沉淀不溶解 | |
| B. | 除去乙酸乙酯中混有的乙酸:混合液$\stackrel{饱和碳酸钠溶液振荡}{→}$溶液分层$\stackrel{分液}{→}$得上层液体 | |
| C. | 证明酸性条件下H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 鉴定盐A的成分是FeBr2: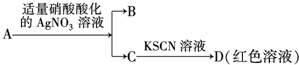 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 甲苯能与浓硝酸、浓硫酸反应生成TNT | |
| C. | 苯酚能与FeCl3溶液发生显色反应 | |
| D. | 苯酚具有酸性,能与碳酸钠溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂,能增大氢气的转化率 | |
| B. | 增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率 | |
| C. | 采用正向催化剂时,反应的活化能降低,使反应明显加快 | |
| D. | 工业生产中,合成氨采用的压强越高,温度越低,越有利于提高经济效益 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2+2OH- | |
| C. | 氨水溶解氯化银固体:AgCl+2NH3•H2O═[Ag(NH3)2]++Cl-+2H2O | |
| D. | 将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M有3种不同的官能团 | |
| B. | M可发生取代、加成、消去和聚合等4种有机反应 | |
| C. | 1molM完全燃烧生成CO2和H2O,需要5molO2 | |
| D. | 1molM与足量的NaOH溶液反应,最多需要4molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
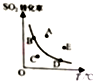 对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )| A. | A点 | B. | B、D两点 | C. | C点 | D. | A、E两点 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
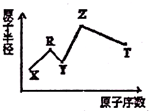 现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题:
现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1molN2和3molH2H混合,充分反应后转移电子数为6NA | |
| B. | 常温下,5.6gFe与足量浓硝酸作用转移电子数一定为0.3NA | |
| C. | 65gZn与一定量的浓硫酸反应至完全溶解,转移电子数一定为2NA | |
| D. | 6.4g由S2、S4、S8组成的混合物中含有硫原子的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com