
分析 (1)太阳能电池将太阳能转化为电能;
(2)硅在自然界中含量丰富,主要以硅酸盐和二氧化硅的形式存在,仅次于氧,硅作为一种普遍使用的新型能源被开发利用说明燃烧放出的热量大,硅燃烧生成二氧化硅;
(3)通入100mL 1mol•L-1的NaOH溶液恰好反应说明生成的氯化氢为0.1mol,然后根据方程式进行计算.
解答 解:(1)硅光电池将太阳能转化为电能,太阳能热水器是将太阳能转化为内能,故答案为:光;电;
(2)A.硅常温下为固体,性质较稳定,便于贮存,较为安全,故A正确;
B.硅在自然界中含量丰富,仅次于氧,故B正确;
C.硅作为一种普遍使用的新型能源被开发利用说明燃烧放出的热量大,硅燃烧生成二氧化硅,二氧化硅是固体,容易得至有效控制,故C正确;
D.催化剂只能加快化学反应的速率,不改变反应热,故D错误.
故答案为:D;
(3)通入100mL 1mol•L-1的NaOH溶液恰好反应说明生成的氯化氢为0.1mol,设反应吸收的热量为x.
2H2(g)+SiCl4(g)═Si(s)+4HCl(g)△H=+240.4kJ•mol-1
4 240.4
0.1 x
$\frac{4}{0.1}$=$\frac{240.4}{x}$
解得X=6.01kJ,
故答案为:吸收;6.01.
点评 本题考查较为综合,涉及化学反应与能量变化以及元素化合物知识,侧重于化学与生活、生产的考查,有利于培养学良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:选择题
| A. |  | B. | 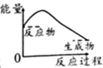 | C. |  | D. | 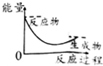 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
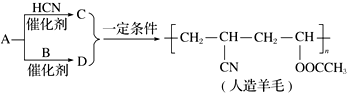
| A. | 合成人造羊毛的反应属于缩聚反应 | B. | A生成C的反应属于加成反应 | ||
| C. | A生成D的反应属于取代反应 | D. | 烃A的结构简式为CH2═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要配制0.50mol/L NaCl溶液480mL.
实验室需要配制0.50mol/L NaCl溶液480mL.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
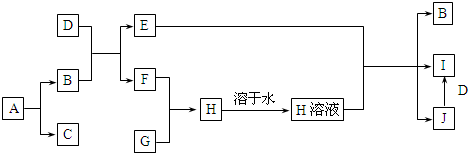 请回答下列问题:
请回答下列问题: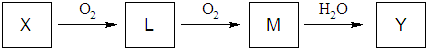
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁粉投入FeCl3溶液中 Fe+2Fe3+=2Fe2+ | |
| B. | 碳酸钙与盐酸反应 CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钠溶液与稀硫酸反应 H++OH-=H2O | |
| D. | 铁与盐酸反应 2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
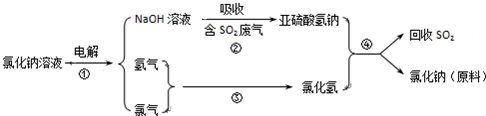
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
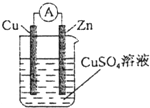
| A. | 铜棒为正极 | B. | 锌棒发生氧化反应 | ||
| C. | 电流从铜棒经外电路流向锌棒 | D. | 锌棒质量增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com