
| A. | 盐酸、苛性钠、偏铝酸钠 | B. | 硅酸、乙醇、小苏打 | ||
| C. | 硫酸、纯碱、硅酸钠 | D. | 碳酸、烧碱、一水合氨 |
分析 酸是指电离时生成的阳离子全部是氢离子的化合物;
碱是指电离时生成的阴离子全部是氢氧根离子的化合物;
盐是指由金属离子(或铵根离子)和酸根离子组成的化合物,根据以上概念和物质组成分析.
解答 解:A、盐酸属于酸,苛性钠即氢氧化钠属于碱,偏铝酸钠是钠离子和偏铝酸根离子构成属于盐,故A正确;
B、硅酸为酸,乙醇属于醇类不是碱,小苏打是碳酸氢钠,是钠离子和碳酸氢根离子构成属于盐,故B错误;
C、硫酸是酸,纯碱即碳酸钠是由钠离子和碳酸酸根离子组成的化合物属于盐,硅酸钠是硅酸根离子和钠离子构成属于盐,故C错误;
D、碳酸是酸,烧碱是氢氧化钠属于碱,一水合氨是碱不是盐,故D错误;
故选A.
点评 本题考查了酸、碱、盐的概念辨析,要充分理解酸碱盐的概念的含义,只有这样才能对各种物质进行正确的分类,题目较简单.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化(Q1、Q2、Q3均大于0) |
| 甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1KJ热量 |
| 乙 | 1molCH3OH | a2 | c2 | 吸收Q2KJ热量 |
| 丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3KJ热量 |
| A. | a1+a3=1 | B. | 2Q1=Q3 | C. | c1=c2 | D. | 2a1=a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 | B. | +1 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤①③②④ | B. | ④②③①⑤ | C. | ①⑤③②④ | D. | ①⑤③④② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
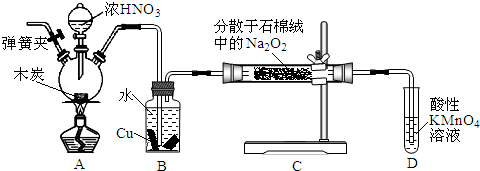
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制容器可以贮运浓硝酸 | B. | 甲醛可用作浸制标本 | ||
| C. | 碳酸氢钠可用来治疗胃酸过多 | D. | 明矾可用作消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com