
【题目】短周期元素 A、B、C、D 的原子序数依次递增,它们的核电荷数之和 32,原子最外层电子数之和为 10,A与 C同主族,B与 D同主族,A、C原子最外层电子数之和等于 B 原子的次外层电子数,则下列叙述中正确的是
A.一定条件下,B 单质能置换出 D 单质,C 单质能置换出 A 单质
B.四种元素的原子半径:r(A)<r(B)<r(C)<r(D)
C.B、D 的最高价氧化物中,B、D 与氧原子均为双键
D.D 元素处于元素周期表中第 3 周期第Ⅳ族
【答案】A
【解析】
短周期元素 A、B、C、D 的原子序数依次递增,A与C同主族,B与D同主族,则B为第二周期元素,D为第三周期元素;B为第二周期元素,B 原子的次外层电子数为2,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,则2x=2,x=1,则A为H元素,C为Na元素;原子最外层电子数之和为10,则B为C元素,D为Si元素,它们的核电荷数之和为32,即1+6+11+14=32,符合题意,据此分析解答。
根据上述分析,A为H元素,B为C元素,C为Na元素,D为Si元素。
A.因C+SiO2 ![]() Si+2CO↑,2Na+2H2O═2NaOH+H2↑,即B单质能置换出D单质,C单质能置换出A单质,故A正确;
Si+2CO↑,2Na+2H2O═2NaOH+H2↑,即B单质能置换出D单质,C单质能置换出A单质,故A正确;
B.电子层数越多,半径越大,在同一周期从左到右原子半径在减小,则原子半径C>D>B>A,故B错误;
C.因二氧化碳中存在C=O键,而二氧化硅中不存在双键,只有Si-O键,故C错误;
D.因硅有3个电子层,最外层电子数为4,则D在周期表中位于第三周期第ⅣA族,故D错误;
故选A。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】化学来源于生活又服务于生活,请用化学用语回答下列问题:
(1)漂粉精中有效成分的化学式为:___________
(2)“硅材料”是无机非金属材料的主角,其中广泛应用于光导纤维的材料是:____________
(3)向浑浊的水中加入明矾KAl(SO4)2·12H2O后,水可得到净化。写出明矾在水中的电离方程式:___________。往明矾溶液中逐滴加入Ba(OH)2溶液,若使SO42- 恰好完全沉淀,发生反应的离子方程式为:___________;若使Al3+恰好完全沉淀,发生反应的离子方程式为:_____。
(4)饮用水中的NO3-对人类健康产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为: 10Al + 6NaNO3 + 4NaOH = 10NaAlO2 + 3N2↑ + 2H2O
请回答下列问题:
①在化学方程式上用单线桥标出该反应中电子转移的方向和数目:____________
②上述反应中若生成标准状况下3.36LN2,则转移的电子数目为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益.其分子结构如图所示,下列说法不正确的是( )
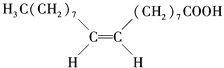
A. 油酸的分子式为C18H34O2
B. 油酸可与氢氧化钠溶液发生中和反应
C. 1mol油酸可与2molH2发生加成反应
D. 1mol甘油可与3mol油酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院将诺贝尔化学奖授予古迪纳夫等三位科学家,表彰他们在锂离子电池方面的研究成果,钴酸锂电池是他们的研究成果之一,其工作原理为LixC6+Li1-xCoO2![]() C6+LiCoO2。下列说法正确的是
C6+LiCoO2。下列说法正确的是
A.放电时Li+从正极通过导线流向负极
B.放电时负极的电极反应式为:LixC6-xe-=C6+xLi+
C.充电时电池的负极与电源的正极相连
D.充电时阴极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为乙醇催化氧化实验的改进装置:

操作步骤:![]() 打开止水夹a,给C中的氧化铜加热一分钟左右;
打开止水夹a,给C中的氧化铜加热一分钟左右;![]() 用针管B向试管中推入少量
用针管B向试管中推入少量![]() 滴
滴![]() 乙醇;
乙醇;![]() 撤离酒精灯,用针管A向C中慢慢推入空气;
撤离酒精灯,用针管A向C中慢慢推入空气;![]() 关闭止水夹a,充分震荡D,静置到温水中
关闭止水夹a,充分震荡D,静置到温水中
(1)仪器C的名称______;
(2)证明有新产物生成的实验现象是______;
(3)检查虚线框部分装置气密性的操作为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。
已知:①CO的燃烧热△H1=-283kJmol-1
②N2(g)+O2(g)2NO(g) △H2=+183kJmol-1
则写出CO和NO反应生成无污染气体的热化学反应方程式________ 。
(2)一定压强下,在容积为2L的密闭容器中充入1molCO与2molH2,在催化剂作用下发生反应:CO(g)+2H2(g)CH3OH(g) △H ,CO转化率与温度和压强的关系如下图所示。
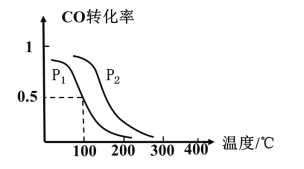
①反应的△H____ 0 ,p1___ p2(填>、< 或=)
②100℃时,反应进行了10秒达到平衡状态,用CO表示该反应的化学反应速率是______ ,该反应的化学平衡常数K=____ 。
③下列说法正确的是______。
A.若容器内气体密度恒定,反应达到平衡状态 B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,△H>0 D.反应中,催化剂使平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X反应的化学方程式_______。
(2)D的气态氢化物的VSEPR模型的名称为_______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数比= _______________。
(4)要证明太阳上是否含有R 元素,可采用的方法是__________________________。
(5)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是_________(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______________________。
(6)往O2+溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,写出沉淀溶解的离子方程式_____。
(7)若F 、K两种元素形成的化合物中中心原子的价电子全部参与成键,则该化合物的空间构型的名称为___。
(8)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是__(填m、n、x或y)。

(9)1183 K以下纯N晶体的基本结构单元如 所示,1183 K以上转变为
所示,1183 K以上转变为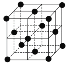 所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com