
| 11.2L |
| 22.4L/mol |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
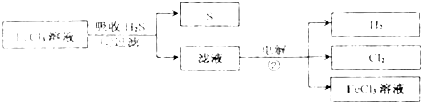
| A、可采取在足量空气中充分燃烧的方法消除H2S的污染 |
| B、反应②中的阴极反应式为2H++2e-═H2↑,电解后所得溶液呈酸性 |
| C、如反应①中H2S过量,则反应离子方程式为:2Fe3++3H2S═2FeS↓+S↓+6H+ |
| D、此反应流程图中可循环利用的物质是FeCl3溶液,FeCl3可用作杀菌、消毒剂和净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
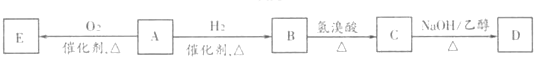
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
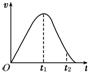 把除去氧化膜的镁条放入盛有一定浓度的稀盐酸的试管中,发现H2的生成速率v随时间t的变化关系如图所示.其中O~t1段速率变化的主要因素是
把除去氧化膜的镁条放入盛有一定浓度的稀盐酸的试管中,发现H2的生成速率v随时间t的变化关系如图所示.其中O~t1段速率变化的主要因素是查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 |
| 乙醇 | -144 | 78.0 | 0.789 |
| 乙酸 | 16.6 | 118 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0,900 |
| 浓硫酸(98%) | - | 338 | 1.84 |
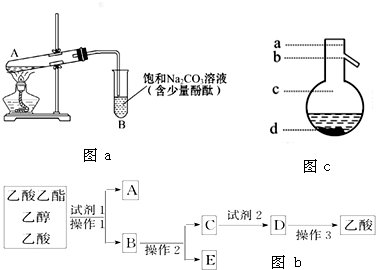
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.| 编号 | 实验目的 | 炭粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
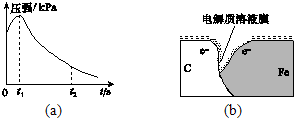 (3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
(3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COOH)>c(CH3COO-) |
| C、c(H+)<c(OH-) |
| D、c(CH3COO-)>+c(CH3COOH)=0.02mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com