
| A. | $\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | OH-的物质的量 | ||
| C. | c(H+)×c(OH-) | D. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$、 |
分析 加水稀释促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,导致溶液中c(OH-)、c(NH3.H2O)、c(NH4+)都减小,温度不变,离子积常数不变,则溶液中c(H+)增大,据此分析解答.
解答 解:加水稀释促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,导致溶液中c(OH-)、c(NH3.H2O)、c(NH4+)都减小,温度不变,离子积常数不变,则溶液中c(H+)增大,
A.稀释后溶液中溶c(OH-)减小,温度不变,电离平衡常数不变,则 $\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O).c(O{H}^{-})}$=$\frac{{K}_{b}}{c(O{H}^{-})}$增大,故A错误;
B.加水稀释促进一水合氨电离,则溶液中n(OH-)增大,故B错误;
C.温度不变离子积常数不变,则c(H+)×c(OH-)=Kw不变,故C错误;
D.稀释后溶液中c(NH4+)减小,温度不变电离平衡常数不变,则$\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$=$\frac{c(N{H}_{3}.{H}_{2}O).c(N{{H}_{4}}^{+})}{c(O{H}^{-}).c(N{{H}_{4}}^{+})}$=$\frac{c(N{{H}_{4}}^{+})}{{K}_{b}}$减小,故D正确;
故选D.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生判断及知识灵活运用能力,正确利用电离平衡常数是解本题关键,注意AD中式子的灵活改变,题目难度中等.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-═2BaBO4↓+AlO2-+2H2O | |
| C. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO-3+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| D. | 向Fe(NO3)2溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO (l) | B. | CH3CHO (g) | C. | CO(g) | D. | CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+有较强的吸附性 | |
| B. | Al3+与悬浮物生成沉淀 | |
| C. | Al3+与水反应生成的氢氧化铝胶体,具有吸附性 | |
| D. | 明矾难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
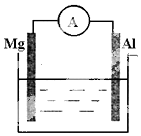 如图所示装置:
如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱、液态氧、碘酒 | B. | 硫磺、白磷、小苏打 | ||
| C. | 干冰、铁、氯化氢 | D. | 空气、氮气、氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 完成下列问题:
完成下列问题:| 实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com