
分析 (1)碘水的颜色影响白色沉淀的观察,可以选用萃取剂把碘萃取出来;
①沉淀和过滤均要用到的玻璃仪器是烧杯、漏斗、玻璃棒;
②沿玻璃棒向过滤器中加蒸馏水至浸没沉淀,待水自然流净后,重复2-3次,据此洗涤沉淀;
(2)根据“在新制Cu(OH)2浊液中滴入N2H4•H2O水溶液,同时产生无色无味的气体”判断反应物、生成物,然后写出反应的化学方程式;
①电解池中阳极发生氧化反应,铜失去1个电子与氯离子结合生成氯化亚铜沉淀,据此写出阳极反应方程式;
②根据阴极阳极的反应式分析;
③电解电路中通过0.2mol电子,理论上生成Cu2O也为0.2mol,再计算质量.
解答 解:(1)碘水是棕褐色的影响白色沉淀的观察,可以用四氯化碳把碘单质萃取出来,由于酒精与水以任意比例混溶,因此不能做萃取剂;
故答案为:B;
①沉淀和过滤均要用到的玻璃仪器是烧杯、漏斗、玻璃棒;
故答案为:烧杯、漏斗、玻璃棒;
②沿玻璃棒向过滤器中加蒸馏水至浸没沉淀,待水自然流净后,重复2-3次,据此洗涤沉淀;
故答案为:沿玻璃棒向过滤器中加蒸馏水至浸没沉淀,待水自然流净后,重复2-3次;
(2)在新制Cu(OH)2浊液中滴入N2H4•H2O水溶液,产生无色无味的气体,根据化合价变化,铜离子化合价降低被还原,能够被氧化生成无色无味的气体可能为N、O元素,由于氧气具有氧化性,不可能生成氧化亚铜,所以该气体只能是氮气,根据化合价升降法配平,反应的化学方程式为:4Cu(OH)2+N2H4•H2O═2Cu2O+N2↑+7H2O;
故答案为:4Cu(OH)2+N2H4•H2O=2Cu2O+N2+7H2O;
①铜作阳极,石墨作阴极,在含有NaOH的NaCl水溶液中电解,在阳极生成难溶CuCl,再与NaOH反应转化为Cu2O,阳极电极反应式为:2Cu+2OH--2e-=Cu2O+H2O;
故答案为:2Cu+2OH--2e-=Cu2O+H2O;
②阳极电极反应式为:2Cu+2OH--2e-=Cu2O+H2O,阴极反应式为:2H2O+2e-=H2+2OH-,转移电子数相等,电解后溶液中c(OH-)不变;
故答案为:不变;
③若电解电路中通过0.2mol电子,根据2Cu+2OH--2e-=Cu2O+H2O,理论上生成Cu2O的质量为0.2mol×144g/mol=28.8g;
故答案为:28.8g.
点评 本题考查了物质的制备,涉及实验操作、物质的性质、电解原理离子方程式书写以及据化学方程式的计算,题目难度不大,注意基础知识的掌握与灵活运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | Fe+CuSO4═Cu+FeSO4 | ||
| C. | 2NaHCO3═Na2CO3+CO2↑+H2O | D. | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验原理 | m=cVM |
| 实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管 |
| 实验步骤 | (1)计算:溶质Na2SO4固体的质量为28.4g. (2)称量:用托盘天平称取所需Na2SO4固体. (3)溶解:将称好的Na2SO4固体放入烧杯中,用适量蒸馏水溶解. (4)转移、洗涤:将烧杯中的溶液冷却至室温并注入仪器①中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入仪器①中. (5)定容:将蒸馏水注入仪器至液面离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切. (6)摇匀:盖好瓶塞,反复上下颠倒,然后静置. |
| 思考与探究 | (1)实验步骤(3)、(4)中都要用到玻璃棒,其作用分别是搅拌、引流 (2)某同学在实验步骤(6)后,发现凹液面低于刻度线,该同学所配置溶液是浓度=(填“>”、“=”或“<”)0.4mol/L. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气燃烧对环境影响的问题尚无定论 | |
| B. | 氢气的制备耗能很大,廉价制氢的技术尚未成熟 | |
| C. | 氢气分子的结构尚未完全研究清楚 | |
| D. | 氢气燃烧产生的热量低于相同质量的矿物燃料,经济效益欠佳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.5mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA | |
| B. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| C. | 室温下,1L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| D. | ag某气体含分子数为b,c g该气体在标况下的体积为$\frac{22.4ab}{c{N}_{A}}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
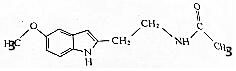 某保健品脑白金包装盒内附有一张产品说明书,其中给出了该产品的主要成分的结构简式(如图).
某保健品脑白金包装盒内附有一张产品说明书,其中给出了该产品的主要成分的结构简式(如图).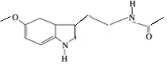 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8gNH4+中含有的电子数为1.1NA | |
| B. | 2.2gCO2和N2O的混合气体中原于数为0.15NA | |
| C. | 1molNa2O2与足量CO2反应,转移电子数为2NA | |
| D. | 25℃、101kPa时,2.24LCH4含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1mol•L-1HF溶液中pH=1 | |
| B. | 向AgI饱和溶液中加入NaCl溶液,不会有AgCl沉淀析出 | |
| C. | 25℃时,使AgCl转化为AgI,则加入KI溶液的浓度不低于5×10-12mol/L | |
| D. | 向1L 0.1mol/LHF溶液中加入1L 0.1mol/LCaCl2溶液,没有沉淀产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com