
 乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示:回答下列问题:
乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示:回答下列问题:分析 乙醇在浓硫酸加热的条件下发生消去反应得F为CH2=CH2,根据G的分子式可知,乙醇与氧气发生氧化得G为CH3CHO,根据A的分子式可知,乙醇氧化得A为CH3COOH,A与乙醇发生酯化反应得B为CH3COOCH2CH3,乙醇与氯气发生取代反应得C为CH2ClCH2OH,C在浓硫酸的作用下发生消去反应得D为CH2=CHCl,D发生加聚反应得E为 ,据此分析解答.
,据此分析解答.
解答 解:乙醇在浓硫酸加热的条件下发生消去反应得F为CH2=CH2,根据G的分子式可知,乙醇与氧气发生氧化得G为CH3CHO,根据A的分子式可知,乙醇氧化得A为CH3COOH,A与乙醇发生酯化反应得B为CH3COOCH2CH3,乙醇与氯气发生取代反应得C为CH2ClCH2OH,C在浓硫酸的作用下发生消去反应得D为CH2=CHCl,D发生加聚反应得E为 ,
,
(1)根据上面的分析可知,F的结构式为CH2=CH2,
故答案为:CH2=CH2;
(2)B为CH3COOCH2CH3,B的化学名称是乙酸乙酯,
故答案为:乙酸乙酯;
(3)由乙醇生产C的化学反应类型为CH3CH2OH+Cl2 $\stackrel{光照}{→}$CH2ClCH2OH+HCl,
故答案为:CH3CH2OH+Cl2 $\stackrel{光照}{→}$CH2ClCH2OH+HCl;
(4)C到D的反应方程式为CH2ClCH2OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCl+H2O,
故答案为:CH2ClCH2OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCl+H2O;
(5)由乙醇生成G的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O.
点评 本题考查有机物推断,为高频考点,以A为突破口结合反应条件进行推断,熟悉常见有机物结构简式、官能团及其性质关系,题目难度不大.


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的醋酸溶液与pH=12的氢氧化钠溶液等体积混合,混合后溶液pH=7 | |
| B. | 将0.1mol•L-1氢氧化钠溶液与pH=1稀硫酸等体积混合,混合后的溶液pH<7 | |
| C. | 硫酸铵溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | pH相同的醋酸钠溶液、碳酸氢钠溶液、碳酸钠溶液,其物质的量浓度: c(CH3COONa)>c(NaHCO3)>c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 相关信息 |
| X | X元素可形成自然界中硬度最大的物质 |
| Y | 其单质为双原子分子,其最简单氢化物的水溶液能使酚酞变红 |
| Z | Z是短周期内最容易失去电子的元素 |
| M | M的一种同位素的质量数为34,中子数为18 |
| N | N是具有紫红色光泽的金属,有很好的延展性、导热性和导电性 |
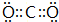 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量.
已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量的H2与Cl2,H2的分子数一定比Cl2多 | |
| B. | 0.5mol氢的质量是0.5g | |
| C. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| D. | 0.1mol H2SO4含有氢原子数的精确值为1.204×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO2和CO是工业排放的对环境产生影响的废气.
CO2和CO是工业排放的对环境产生影响的废气.| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.01 | 0.2 | 0.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com