
вбжЊЃК2H2 ( g ) + O2 ( g ) = 2H2O ( l ); ЁїH = Ѓ571.6 kJ/mol
2H2 ( g ) + O2 ( g ) = 2H2O ( g ); ЁїH = Ѓ483.6 kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ); ЁїH = Ѓ890 kJ/mol
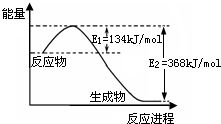
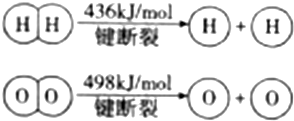
БъзМзДПіЯТЃЌШЁМзЭщКЭЧтЦјЕФЛьКЯЦјЬх11.2 LЭъШЋШМЩеКѓЛжИДЕНГЃЮТЃЌдђЗХГіЕФШШСПЮЊ203.32kJЃЌЪдЧѓЛьКЯЦјЬхжаМзЭщКЭЧтЦјЬхЛ§БШЁЃ

| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
 ЕЊЪЧЕиЧђЩЯКЌСПЗсИЛЕФвЛжждЊЫиЃЌЦфЕЅжЪМАЛЏКЯЮядкЙЄХЉвЕЩњВњЁЂЩњЛюжагазХживЊзїгУЃЎ
ЕЊЪЧЕиЧђЩЯКЌСПЗсИЛЕФвЛжждЊЫиЃЌЦфЕЅжЪМАЛЏКЯЮядкЙЄХЉвЕЩњВњЁЂЩњЛюжагазХживЊзїгУЃЎ| T/K | 398 | 498 |
| ЦНКтГЃЪ§K | K1 | K2 |
| c2(NH3) |
| c(N2)ЁСc3(H2) |
| c2(NH3) |
| c(N2)ЁСc3(H2) |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com