
| Ń”Ļī | ¹ęĀÉ | ½įĀŪ |
| A | Ķ¬Ö÷×åŌŖĖŲŠŌÖŹµÄĻąĖĘŠŌ | ÄĘŗĶŃõ·“Ó¦æÉŅŌŠĪ³ÉNa2O2£¬Ņ²æÉŅŌŗĶĮņŠĪ³ÉNa2S2 |
| B | ·“Ó¦ĪļÅضČŌ½“󣬷“Ó¦ĖŁĀŹŌ½æģ | ³£ĪĀĻĀ£¬ĻąĶ¬µÄĢśĘ¬·Ö±š¼ÓČė×ćĮæµÄĻ”ĮņĖįŗĶÅØĮņĖįÖŠ£¬ÅØĮņĖįÖŠĢśĘ¬ĻČČܽāĶź |
| C | ½į¹¹ŗĶ×é³ÉĻąĖʵÄĪļÖŹ£¬·ŠµćĖęĻą¶Ō·Ö×ÓÖŹĮæŌö“ó¶ųÉżøß | H2O·ŠµćµĶÓŚH2S |
| D | ½ĻĒæĖįæÉŅŌÖĘČ”½ĻČõĖį | ŃĒĮņĖįŗĶ“ĪĀČĖįøĘ·“Ó¦æÉŅŌÖĘČ”“ĪĀČĖį |
| A£® | A | B£® | B | C£® | C | D£® | D |
·ÖĪö A£®Ķ¬Ö÷×åŌŖĖŲ×īĶā²ćµē×ÓŹżĻąµČ£¬ŠŌÖŹĻąĖĘ£»
B£®³£ĪĀĻĀ£¬ÅØĮņĖįŗĶFe·¢Éś¶Ū»ÆĻÖĻó£»
C£®OµÄ·Ē½šŹōŠŌ½ĻĒ棬H2O·Ö×ÓÖ®¼ä“ęŌŚĒā¼ü£»
D£®“ĪĀČĖįÓŠĒæŃõ»ÆŠŌ£®
½ā“š ½ā£ŗA£®Ķ¬Ö÷×åŌŖĖŲ×īĶā²ćµē×ÓŹżĻąµČ£¬ÄĘŗĶŃõ·“Ó¦æÉŅŌŠĪ³ÉNa2O2£¬Ņ²æÉŅŌŗĶĮņŠĪ³ÉNa2S2£¬¹ŹAÕżČ·£»
B£®³£ĪĀĻĀ£¬ÅØĮņĖįŗĶFe·¢Éś¶Ū»ÆĻÖĻó£¬×čÖ¹ĮĖ·“Ó¦µÄ¼ĢŠų½ųŠŠ£¬Ļ”ĮņĖįÖŠĢśĘ¬ĻČČܽāĶź£¬¹ŹB“ķĪó£»
C£®H2O·Ö×ÓÖ®¼ä“ęŌŚĒā¼ü£¬Ź¹Ė®µÄČŪ·ŠµćÉżøߣ¬ĖłŅŌH2O·ŠµćøßÓŚH2S£¬¹ŹC“ķĪó£»
D£®“ĪĀČĖįÓŠĒæŃõ»ÆŠŌ£¬Äܱ»ŃĒĮņĖįøĘ»¹Ō£¬¹ŹD“ķĪó£»
¹ŹŃ”A£®
µćĘĄ ±¾Ģāæ¼²é»ÆѧŹµŃé·½°øĘĄ¼Ū£¬ĪŖøßæ¼øßʵµć£¬ĢāÄæÄѶČÖŠµČ£¬²ąÖŲæ¼²é»ł±¾ŌĄķ”¢»Æѧ·“Ó¦ĖŁĀŹµČÖŖŹ¶µć£¬Ć÷Č·ŌŖĖŲ»ÆŗĻĪļÖŖŹ¶”¢ĪļÖŹŠŌÖŹ¼“æɽā“š£¬ŹŌĢāÅąŃųĮĖѧɜµÄĀß¼ĶĘĄķÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Õō·¢”¢½į¾§ÓėÕō·¢Ćó | B£® | ¹żĀĖÓėĀ©¶· | ||
| C£® | ŻĶČ””¢·ÖŅŗÓė·ÖŅŗĀ©¶· | D£® | ÕōĮóÓėÕōĮó×°ÖĆ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ÓČėĀČĖ®Õńµ“£¬¹Ū²ģĖ®²ćŹĒ·ńÓŠŗģ×ŲÉ«³öĻÖ | |
| B£® | µĪČė AgNO3ČÜŅŗ£¬ŌŁ¼ÓČėĻ” HNO3£¬¹Ū²ģÓŠĪŽĒ³»ĘÉ«³ĮµķÉś³É | |
| C£® | ¼ÓČė NaOH ČÜŅŗ¹²ČČ£¬Č»ŗó¼ÓČėĻ” HNO3Ź¹ČÜŅŗ³ŹĖįŠŌ£¬ŌŁµĪČė AgNO3ČÜŅŗ£¬¹Ū²ģÓŠĪŽĒ³»ĘÉ«³ĮµķÉś³É | |
| D£® | ¼ÓČė NaOH ČÜŅŗ¹²ČČ£¬ĄäČ“ŗó¼ÓČė AgNO3ČÜŅŗ£¬¹Ū²ģÓŠĪŽĒ³»ĘÉ«³ĮµķÉś³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ąė×Ó·“Ó¦ | B£® | ĪüČČ·“Ó¦ | C£® | ø“·Ö½ā·“Ó¦ | D£® | Ńõ»Æ»¹Ō·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½«Ņ»æé“ųÓŠŃõ»ÆĤµÄĀĮʬÓė¹żĮæµÄÅØNaOHČÜŅŗĶźČ«·“Ó¦ŗó£¬Č”³ĪĒåČÜŅŗ½«ĘäÕōøÉ£¬µĆ“æ¾»µÄNaAlO2¹ĢĢå | |
| B£® | ĻņNaAlO2ČÜŅŗÖŠ¼ÓČė¹żĮæµÄA1C13ČÜŅŗ£¬½«ĖłµĆ³Įµķ¹żĀĖĻ“µÓ£¬¼ÓČČ×ĘÉÕČ„µōĖ®·Ö£¬æÉµĆ“æ¾»µÄA1£ØOH£©3¹ĢĢå | |
| C£® | °ŃĀĮæéÓėŹŹĮæµÄĻ”ŃĪĖįĶźČ«·“Ó¦£¬½«ĖłµĆČÜŅŗÕōøÉ£¬æɵĆAlCl3¹ĢĢå | |
| D£® | AlC3ČÜŅŗÓė×ćĮæ°±Ė®·“Ó¦£¬½«³Įµķ¹żĀĖ”¢Ļ“µÓ”¢×ĘÉÕČ„µōĖ®·ÖæɵĆAl2O3¹ĢĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øł¾ŻŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆ£¬ĶĘ²āŌŖĖŲµÄŌ×Ó½į¹¹ | |
| B£® | Öøµ¼ŠĀŌŖĖŲµÄ·¢ĻÖŗĶŗĻ³É£¬Ō¤²āŠĀŌŖĖŲµÄŠŌÖŹ | |
| C£® | ŌŚ½šŹōÓė·Ē½šŹōµÄ·Ö½ēĻßø½½üŃ°ÕŅ°ėµ¼Ģå²ÄĮĻ | |
| D£® | ŌŚĮć×åŌŖĖŲÖŠŃ°ÕŅÄĶøÆŹ“µÄ½šŹō²ÄĮĻ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | v£ØA2£©=0.4 mol•L-1•s-1 | B£® | v£ØD£©=6 mol•L-1•min-1 | ||
| C£® | v£ØC£©=0.6 mol•L-1•s-1 | D£® | v£ØB2£©=0.8 mol•L-1•s-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
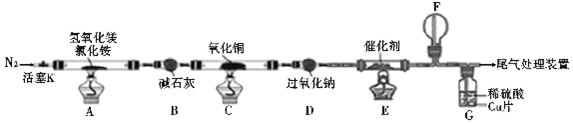
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com