

| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| I | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| II | 探究温度对降解速率的影响 | ① | ② | ③ | ④ |
| III | ⑤ | 298 | 10 | 6.0 | 0.30 |
分析 (1)羟基中O原子有两个未成对电子,与H成一根共价键后,还有一个未成对电子,据此写出羟基自由基的电子式;
(2)羟基自由基的氧化能力仅次于氟,因此羟基自由基有强氧化性,与废水中的苯酚发生反应,反应生成CO2和水,据此写出反应方程式;
(3)反应为Fe3++SCN-=Fe (SCN)2+,该反应的平衡常数为$K=\frac{c[Fe(SCN)^{2+}]}{c(SC{N}^{-})c(F{e}^{3+})}$,将平衡时浓度代入计算,考虑到羟基自由基具有强氧化性,可以氧化SCN-,据此分析不能检验Fe3+的原因;
(4)实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K,设计对比实验,根据图表分析,整个实验都以I为参照,采用控制变量法探究,①处应填温度,该栏对应的是探究温度的影响,要改变温度,数据应与I中不同,②处填pH值,但不是探究pH值的影响,则数据应与I中的相同,⑤处填实验内容,是探究pH对反应的影响,据此解答;
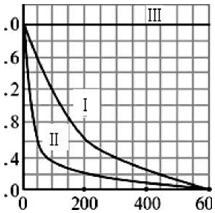
(5)a.根据曲线I,反应经历的时间为△t=300-50=250s,p-CP的浓度改变量为△c=1.6×10-3-0.4×10-3=1.2×10-3mol/L,根据化学反应的平均速率v (p-CP)=$\frac{△c}{△t}$,p-CP原始浓度为2.0×10-3mol/L,300s时浓度为0.4×10-3mol/L,
则300s时反应了p-CP有1.6×10-3mol/L,则300s时的转化率为转化量与原始浓度的比值的百分数,据此计算;
b.实验I、II是探究温度变化对反应的影响,II的温度大于I的温度,根据图象,在相同时间内,II中p-CP的浓度下降更多,降解反应速率更快;
c.实验III是探究pH变化对反应的影响,根据图象,III中p-CP的浓度在pH=10时几乎保持不变,表明反应几乎停止.
解答 解:(1)羟基中O原子有两个未成对电子,与H成一根共价键后,还有一个未成对电子,则羟基自由基的电子式为 ,
,
故答案为: ;
;
(2)羟基自由基的氧化能力仅次于氟,因此羟基自由基有强氧化性,与废水中的苯酚发生反应,反应生成CO2和水,则羟基自由基与废水中苯酚反应的方程式为C6H6O+28•OH═6CO2↑+17H2O,
故答案为:C6H6O+28•OH═6CO2↑+17H2O;
(3)反应为Fe3++SCN-=Fe (SCN)2+,该反应的平衡常数为$K=\frac{c[Fe(SCN)^{2+}]}{c(SC{N}^{-})c(F{e}^{3+})}$,已知平衡时,c (Fe3+)=0.04mol/L,c (SCN-)=0.1mol/L,c[Fe (SCN) 2+]=0.68mol/L,则反应的平衡常数为K=$\frac{0.68mol/L}{0.04mol/L×0.1mol/L}$=170L/mol,
考虑到羟基自由基具有强氧化性,能氧化SCN-,因此不能用该反应来检验Fenton试剂中是否产生Fe3+,原因是羟基自由基会氧化SCN-,
故答案为:170L/mol;不可行,羟基自由基会氧化SCN-;
(4)实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K,设计对比实验,根据图表分析,整个实验都以I为参照,采用控制变量法探究,①处应填温度,该栏对应的是探究温度的影响,要改变温度,数据应与I中不同,故①处填313,
②处填pH值,但不是探究pH值的影响,则数据应与I中的相同,故②处填3,
⑤处填实验内容,是探究pH对反应的影响,故⑤处填探究溶液pH大小对反应速率的影响,
故答案为:313;3;探究溶液pH大小对反应速率的影响;
(5)a.根据曲线I,反应经历的时间为△t=300-50=250s,p-CP的浓度改变量为△c=1.6×10-3-0.4×10-3=1.2×10-3mol/L,则降解反应在50-300s内的平均反应速率v (p-CP)=$\frac{△c}{△t}$=$\frac{1.2×1{0}^{-3}mol/L}{250s}$=4.8×10-6mol/(L•s),根据图象,
p-CP原始浓度为2.0×10-3mol/L,300s时浓度为0.4×10-3mol/L,则300s时的转化率为α=$\frac{1.6×1{0}^{-3}mol/L}{2.0×1{0}^{-3}mol/L}×100%$=80%,
故答案为:4.8×10-6mol/(L•s);80%;
b.实验I、II是探究温度变化对反应的影响,II的温度大于I的温度,根据图象,在相同时间内,II中p-CP的浓度下降更多,降解反应速率更快,
故答案为:增大;
c.实验III是探究pH变化对反应的影响,根据图象,III中p-CP的浓度在pH=10时几乎保持不变,表明反应几乎停止,
故答案为:反应基本停止.
点评 本题主要考察化学原理部门知识,包含电子式的书写,氧化还原反应方程式的书写,平衡常数的计算,化学反应速率的计算,转化率的计算,结合图象分析是解题的关键.本题难度不大,是基础题.


科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 乙炔(硫化氢) | 硫酸铜溶液 | 洗气 |
| B | 乙炔(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| D | 苯(甲苯) | 蒸馏水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{92}^{235}$U可用于制造原子弹,也可用作核电站发电的原料 | |
| B. | 利用${\;}_{6}^{14}$C可判断某些文物的生产年代 | |
| C. | 等质量的${\;}_{1}^{2}$H2O、${\;}_{1}^{1}$H2O所含的分子数前者多 | |
| D. | 通过化学反应无法将${\;}_{1}^{2}$H转化为${\;}_{1}^{1}$H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,将x mol•L-1NaOH溶液滴10mL 0.1mol•L-1的醋酸溶液中,溶液的温度和pH变化如图所示.下列说法正确的是( )
室温下,将x mol•L-1NaOH溶液滴10mL 0.1mol•L-1的醋酸溶液中,溶液的温度和pH变化如图所示.下列说法正确的是( )| A. | x=0.1 | |
| B. | 滴定过程中应该选择甲基橙作为指示剂 | |
| C. | c点对应的溶液中水的电离程度最大 | |
| D. | b点对应的溶液中c(H+)=(OH-)=C(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质用途 | 原理 |
| A | 高纯硅常作太阳能电池材料 | 硅是电的良导体 |
| B | 草木灰与铵态氮肥混合使用能提高肥效 | 铵盐与K2CO3在水中发生双水解,有利于NH3逸出 |
| C | 漂粉精能漂白有色衣物等 | 4Fe(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+12NO2↑+3O2↑具有强氧化性,氧化色素 |
| D | 可燃冰是一种具有潜力的清洁能源 | CH4完全燃烧,不产生烟尘 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com