
某强酸性溶液X含有Ba2+、Al3+、NH 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO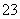 、SO
、SO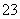 、SO
、SO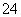 、Cl-、NO
、Cl-、NO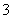 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
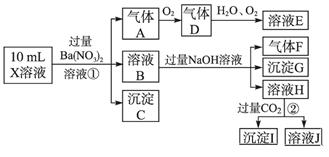
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
【知识点】离子推断B1 D5C5
【答案解析】(1)Al3+、NH 、Fe2+、SO
、Fe2+、SO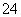

(2)3Fe2++NO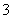 +4H+===3Fe3++NO↑+2H2O
+4H+===3Fe3++NO↑+2H2O
AlO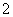 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO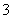
(3)若检验Fe3+肯定存在时,就有Cl-存在,因为肯定存在的离子电荷总数已相等
解析:⑴在强酸性溶液中不可能有CO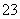 、SO
、SO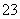 ,溶液X加硝酸钡产生沉淀C(硫酸钡),则说明溶液X中存在SO
,溶液X加硝酸钡产生沉淀C(硫酸钡),则说明溶液X中存在SO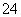 ,不存在Ba2+;生成气体A,则溶液中一定含Fe2+,因为酸性溶液中硝酸根离子具有强氧化性,将Fe2+氧化为Fe3+,则X中没有NO
,不存在Ba2+;生成气体A,则溶液中一定含Fe2+,因为酸性溶液中硝酸根离子具有强氧化性,将Fe2+氧化为Fe3+,则X中没有NO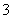 ,得到的气体A为NO,D为NO2,E为HNO3;B溶液和过量氢氧化钠反应生成气体、沉淀、溶液,推断原溶液中一定含NH4+,生成的沉淀G是Fe(OH)3,与碱反应生成的气体F为NH3,溶液H通入过量二氧化碳生成沉淀,判断溶液H中含有AlO2-,则原溶液中一定含有Al3+,沉淀I为Al(OH)3。因此原溶液中一定含有Al3+、NH4+、Fe2+、SO42-。
,得到的气体A为NO,D为NO2,E为HNO3;B溶液和过量氢氧化钠反应生成气体、沉淀、溶液,推断原溶液中一定含NH4+,生成的沉淀G是Fe(OH)3,与碱反应生成的气体F为NH3,溶液H通入过量二氧化碳生成沉淀,判断溶液H中含有AlO2-,则原溶液中一定含有Al3+,沉淀I为Al(OH)3。因此原溶液中一定含有Al3+、NH4+、Fe2+、SO42-。
⑵步骤①的反应是在酸性条件下NO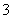 氧化Fe2+:3Fe2++NO
氧化Fe2+:3Fe2++NO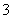 +4H+===3Fe3++NO↑+2H2O,步骤②是过量二氧化碳和偏铝酸钠溶液的反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+H2O=Al(OH)3↓+HCO3-。
+4H+===3Fe3++NO↑+2H2O,步骤②是过量二氧化碳和偏铝酸钠溶液的反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+H2O=Al(OH)3↓+HCO3-。
⑷由于A(NO)、F(NH3)、I(Al(OH)3)均为0.1mol,可知原溶液中n(Al3+)=0.1mol;n(NH4+)=0.1mol,依据电子守恒可知3Fe2+~NO;n(Fe2+)=0.3mol;10mLX溶液中n(H+)=0.4mol,沉淀C(BaSO4)物质的量为0.7mol,则n(SO42-)=0.7mol,依据溶液中电荷守恒得到:正电荷=2c(Fe2+)+3c(Al3+)+c(NH4+)+c(H+)=2×0.3+3×0.1+0.1+0.4=1.4mol;负电荷=2[SO42-]=2×0.7=1.4mol,刚好相等,因此若检验Fe3+肯定存在时,就有Cl-存在。
【思路点拨】本题是根据离子共存关系判断离子的存在,在解题时需注意有没有引入X中所含离子,如步骤①就引入NO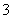 ,则A气体不一定X中的NO
,则A气体不一定X中的NO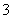 参与反应得到的,定量计算时可根据电荷守恒判断离子的存在。
参与反应得到的,定量计算时可根据电荷守恒判断离子的存在。


科目:高中化学 来源: 题型:
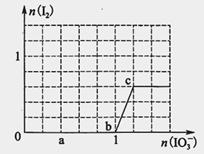
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
(1)写出a点反应的离子方程式________________;反应中还原剂是______________;被还原的元素是__。
(2)写出b点到c点反应的离子方程式_____________________________。
(3)若往100 mL 1 mol·L-1的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列实验设计及其对应的离子方程式均正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾
B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾
C.弱碱性溶液中可能大量存在Na+、K+、Cl‾、HCO3‾
D.中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42‾
查看答案和解析>>
科目:高中化学 来源: 题型:
常见元素A、B、M组成的四种物质发生反应:甲+乙 丙+丁,其中甲由A和M组成,乙由B和M组成,丙只含M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为 ;生成标准状况下5.6L丙转移移电子数为 ;常温下丁溶液pH 7,用离子方程式解释 。
(2)若丁为能使品红褪色的无色气体,丙为常见紫红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。则:
①A在周期表中位置为
②将丁通至FeCl3溶液中的现象为
离子反应方程式为
③正确书写上述生成丙的化学方程式
④向MCl2的溶液中通入丁,可观察到白色的MC1沉淀,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
2014 年 3 月 21 日是第二十二届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的____________倍。
2)某无色废水中可能含有 Fe3+、Al3+、Mg2+、Na+、NO-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品 100 mL,进行了三组实验,其操作和有关现象如下图所示:
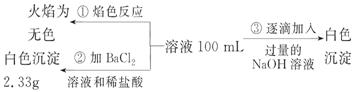
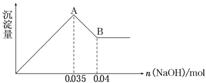
请根据上图回答下列问题:
①实验中需配制 1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管, 还缺少的仪器为_________。
②实验③中沉淀量由 A→B过程中所发生反应的离子方程式为__________。
③试确定NO3-是否存在?_______(填“存在”、“不存在”或“不确定”),若存在,试计算 c(NO3-)=____________(若不存在,此问不必作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
盆烯是近年合成的一种有机物,它的分子结构可简化表示为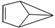 (其中H原子已略去),下列关于盆烯的说法中错误的是( )
(其中H原子已略去),下列关于盆烯的说法中错误的是( )
A.盆烯是苯的一种同分异构体
B.盆烯分子中所有的碳原子不可能在同一平面上
C.盆烯是乙烯的一种同系物
D.盆烯在一定条件下可以发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于150,若已知其中氧的质量分数为50%,则分子中碳原子的个数最多为( )
A.4 B.5 C.6 D.7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com