
| A、工业制硫酸、工业制硝酸、由石英获取单晶硅变化均为氧化还原反应 |
| B、氧化反应与还原反应一定同时发生,但氧化剂、还原剂可不直接接触 |
| C、置换反应肯定都是氧化还原反应,但复分解反应可能是氧化还原反应 |
| D、氧化还原反应中氧化产物与还原产物不会再发生氧化还原反应 |


科目:高中化学 来源: 题型:
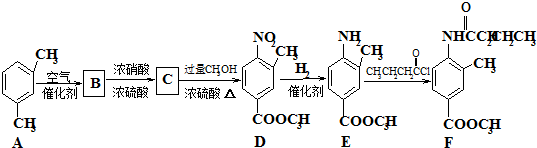
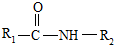 在一定条件下可水解为
在一定条件下可水解为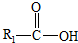 和R2-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是
和R2-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
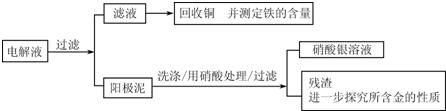
| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3?Au(NO3)3+3NO2↑+3H2O | ≤1 |
| 2 | Au3++4Cl-?Au4Cl4- | ≥1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| O2 |
| H2O |
| A、①③ | B、③④ |
| C、①②④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮肥厂用氢气和氮气合成氨 |
| B、纯碱厂用侯氏制碱法制纯碱 |
| C、硫酸厂用接触法生产硫酸 |
| D、氯碱厂用电解饱和食盐水制烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | ||||
| B、Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | ||||
C、用石墨做电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
| D、强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:4OH-+3ClO-+2Fe(OH)3═2FeO42-+3Cl-+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
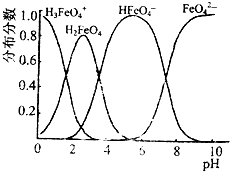 高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醛(HCHO) |
| B、CO |
| C、氡(Rn) |
| D、NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com