
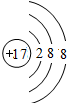
 ,故答案为:
,故答案为: ;
;
| ||
| ||


科目:高中化学 来源: 题型:
| A、从明矾是常用的净水剂可推测凡含有铝元素的物质都有净水作用 |
| B、不同物质各有其特性,明矾可用做净水剂,Al2(SO4)3就不一定有净水作用 |
| C、净水剂就是指能杀灭水中细菌和有害微生物的化学试剂 |
| D、从理论上说,铝盐和铁盐都可用做净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?H3O++CO32- |
| B、足量乙酸与碳酸钠反应的离子方程式:2H++CO32-═CO2↑+H2O |
| C、铁吸氧腐蚀的正极反应:2H2O+O2+4e-═4OH- |
| D、H2SO3的电离方程式H2SO3?2H++SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定条件下,使用催化剂能加快反应速率 |
| B、当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变 |
| C、单位时间内生成CO和消耗Cl2的物质的量比为1:1时,反应达到平衡状态 |
| D、平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)元素的第一电离能:Al
(1)元素的第一电离能:Al查看答案和解析>>
科目:高中化学 来源: 题型:
 元素X的原子最外层电子数是其内层的3倍.元素Y基态原子的3p轨道上有4个电子.元素Z位于第四周期,ⅡB族.
元素X的原子最外层电子数是其内层的3倍.元素Y基态原子的3p轨道上有4个电子.元素Z位于第四周期,ⅡB族.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com