
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 溴水存放在带玻璃塞的无色试剂瓶中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 金属钠保存在煤油中 |
分析 A.液体放在细口瓶中,见光易分解的放在棕色瓶中;
B.溴水见光容易分解;
C.水玻璃具有粘性,玻璃的成分中的二氧化硅能和碱反应;
D.少量钠应保存在煤油中.
解答 解:A.氯水见光时其中的次氯酸会分解,并且属于液体,所以盛放在棕色细口瓶中,故A错误;
B.溴水见光容易分解,需保存在棕色细口瓶中,故B错误;
C.水玻璃具有粘性,能将玻璃瓶口和瓶塞黏在一起,碱性溶液能和玻璃的成分中的二氧化硅反应,所以水玻璃和碱性溶液存放时不能用磨口玻璃塞密封,故C错误;
D.钠是活泼型金属,在常温下和氧气、水反应,少量钠应储存在煤油中,故D正确.
故选D.
点评 本题考查药品的存放知识的,解题的关键是了解特殊存放的原因,并进而做出判断,属基础性实验考查题,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 分子中3个碳原子在同一条直线上 | B. | 分子中所有原子都在同一平面上 | ||
| C. | 能使溴的四氯化碳溶液褪色 | D. | 能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 偏二甲肼既是氧化剂又是还原剂 | |
| B. | 该反应进行时只有放热过程没有吸热过程 | |
| C. | 该反应中氮元素的化合价升高 | |
| D. | 该反应中每生成1mol CO2转移8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
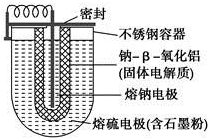 如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为| A. | 外室熔融硫中添加石墨粉主要是为了增强导电性 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时阳极反应式为8S-16e-═nS8 | |
| D. | 充电时钠极与外接电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
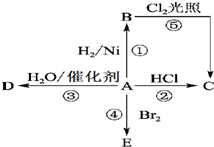 某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A也是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据该图回答下列问题:
某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A也是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据该图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C-O键的极性比N-O键的极性大 | |
| B. | CO和N2互为等电子体,且N2的沸点比CO的高 | |
| C. | H2CO3、H2SiO3、H3PO4酸性越来越弱 | |
| D. | 金属K采用面心立方堆积,空间利用率为74% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com