
【题目】下列各物质投入水中,因促进水的电离而使溶液呈酸性的是( )
A.NaHSO4
B.Na3PO4
C.CH3COOH
D.Al2(SO4)3
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是( ) ①无色溶液中:K+、Cu2+、Na+、SO ![]()
②pH=11的溶液中:CO ![]() 、Na+、Cl﹣、NO
、Na+、Cl﹣、NO ![]()
③加入Mg能放出H2的溶液中:Cl﹣、HCO ![]() 、NO
、NO ![]() 、NH4+
、NH4+
④在由水电离出的c(OH﹣)=10﹣13 molL﹣1的溶液中:Na+、Ba2+、Cl﹣、I﹣
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl﹣、S2﹣、ClO﹣
⑥强酸性溶液中:Fe2+、Al3+、NO ![]() 、Cl﹣ .
、Cl﹣ .
A.①②⑤
B.②④⑥
C.②④
D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关硅元素的下列叙述中正确的是( )
A.硅、碳与氢氟酸都不反应
B.硅是构成矿物岩石的主要原料,其化合态硅几乎全部是硅石和硅酸盐
C.硅与碳性质都很稳定,都能以游离态存在于自然界
D.晶体硅、石墨都可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2 溶液时,沉淀的物质的量随Ba(OH)2 的物质的量的变化关系。该溶液的成分可能是
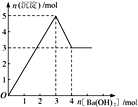
A. MgSO4 B. Al2 (SO4 )3 C. Fe2 (SO4 )3 D. NaAlO2
【答案】B
【解析】A、氢氧化镁不溶于氢氧化钡溶液,沉淀量达最大后,再加氢氧化钡溶液,沉淀量不变,A错误;B、由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-===AlO2-+2H2O可知沉淀中Al(OH)3为2mol,故Al2(SO4)3为1mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+):n(OH-)=2mol:6mol=1:3,发生反应Al3++3OH-===Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,B正确;C、硫酸铁与氢氧化钡溶液反应生成氢氧化铁,氢氧化铁不溶于氢氧化钡,则沉淀量达最大后,再加氢氧化钡溶液,沉淀的量不变,与图象不一致,C错误;D、偏铝酸钠与氢氧化钡不反应,不能产生沉淀,D错误;答案选B。
点睛:本题以图象为载体考查镁铝化合物的性质,明确发生的化学反应是解答的关键,反应发生的先后顺序是学生解答中的难点,注意图象比例关系,注意氢氧化铝两性特点。
【题型】单选题
【结束】
15
【题目】如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是
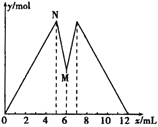
A. N点时溶液中的溶质只有NaCl
B. 原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C. c (NaOH)=c (HCl)
D. M点之前加入的是NaOH溶液,M点之后加入的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能达到实验目的的是 ( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | 铜 | 溴水 | 验证浓硫酸具有强氧化性 | |
B | 浓盐酸 | 浓硫酸 | 空气 | 制取并收集HCl | |
C | 浓氨水 | 氧化钙 | 空气 | 制取并收集NH3 | |
D | 稀硫酸 | Na2CO3 | Na2SiO3 溶液 | 验证酸性:硫酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)无水氯化铝在生产、生活中应用广泛。
①氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为__________。
② 已知:Al2O3(s)+3C(s)2Al(s)+3CO(g) ΔH1= + 1344.1 kJ·mol-1
2AlCl3(g)2Al(s)+3Cl2(g) ΔH2= + 1169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为________________________。
(2)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
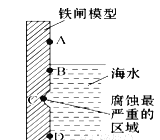
①该电化腐蚀称为 _________________。
②图中A、B、C、D四个区域,生成铁锈最多的是 ____(填字母)。
(3)酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可以得到多种化工原料。
①该电池的负极反应式为 _______________;
②该电池的正极反应式为 _______________;
③电池反应的离子方程式为 ______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验粗盐溶液中的 Cl-(含Ca2+、Mg2+、SO42-),所需的试剂有:
A. Ba(NO3)2 B. BaCl2 C. Na2CO3 D. AgNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com