
| A、Ba2++SO42-═BaSO4↓ |
| B、Fe+2H+═Fe2++H2↑ |
| C、Al2O3+6H+═2Al3++3H2O |
| D、HCO3-+OH-═CO32-+H2O |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
| A、干馏煤可以得到甲烷、苯和氨等重要化工原料 |
| B、油脂、乙醇是人体所必须的营养物质 |
| C、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
| D、为推广氢能的使用,工业上可采用电解水法制取大量氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
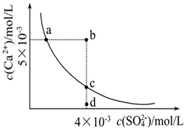 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说| A、常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/LNa2SO4溶液后,溶液中无沉淀析出 |
| B、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L |
| C、d点溶液通过蒸发可以变到c点 |
| D、a点对应的Ksp等于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.1mol/LNaOH溶液 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.1mol/L氨水 | 0.1mol/LMgCl2溶液 | 无现象 |
| Ⅲ | 1mol/L氨水 | 1mol/LMgCl2溶液 | 现象Ⅲ |
| Ⅳ | 1mol/L氨水 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅴ | 0.1mol/L氨水 | 1mol/LMgCl2溶液 | 无现象 |
| A、实验Ⅱ、Ⅴ无现象,而Ⅳ生成白色沉淀,说明增大c(Mg2+)不能向生成沉淀的方向移动,增大氨水溶液的浓度才能向生成沉淀的方向移动 |
| B、实验Ⅲ无现象,因为氯化镁溶液和氨水浓度都增大,则导致氯化铵浓度增大,而氢氧化镁可以溶解在氯化铵溶液中 |
| C、由于氢氧化镁可以溶解在氯化铵溶液中,而氯化镁溶液和氨水反应可以生成氯化铵,所以该两种溶液混合后可能会出现先生成沉淀后溶解的现象 |
| D、实验Ⅲ的现象是生成白色沉淀,因为增大两种溶液中任意一种的浓度,都能使混合液的离子积达到氢氧化镁的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molSO2(g)和0.5molO2(g)置于密闭容器中 在一定条件下充分反应,放热98.3KJ |
| B、若升高温度,正反应速率增大,逆反应速率减小 |
| C、其他条件不变时,加入催化剂,速率一定加快 |
| D、2molSO2(g)和1molO2(g)具有的能量之和大于2molSO3(g)具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
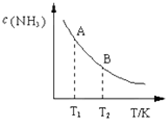 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:| 一定条件 |
| 时间/min 浓度/mol?L-1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀生成和溶解不断进行,但速率相等 |
| B、AgCl难溶于水,其溶液中没有Ag+和Clˉ |
| C、升高温度,AgCl沉淀的溶解度不变 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
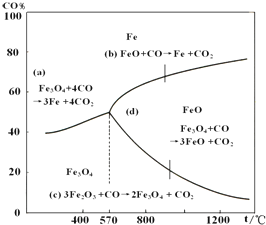 钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉炼铁,常用赤铁矿、焦炭、空气与熔剂(石灰石)作原料.已知赤铁矿被还原剂还原是逐级进行的,还原时温度及CO、CO2平衡混合气中CO的体积分数的关系如图:
钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉炼铁,常用赤铁矿、焦炭、空气与熔剂(石灰石)作原料.已知赤铁矿被还原剂还原是逐级进行的,还原时温度及CO、CO2平衡混合气中CO的体积分数的关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),p(CO32-)=-lgc(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),p(CO32-)=-lgc(CO32-).下列说法正确的是( )| A、MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B、a点可表示MnCO3的饱和溶液,且c(Mn2+)<c(CO32-) |
| C、b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D、c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com