
| A. | ①② | B. | ②③④ | C. | ②④ | D. | ② |
分析 氢硫酸是二元弱酸,在水溶液里存在电离平衡,向溶液中加入和硫离子反应的物质能促进氢硫酸电离,氢离子浓度增大.
解答 解:①向溶液中通入氧气,2H2S+O2═2S↓+2H2O,氢离子浓度减小;
②向溶液中通入氯气,H2S+Cl2═S↓+2HCl,氯化氢是强电解质,氢硫酸是弱电解质,所以导致溶液中氢离子浓度增大;
③向溶液中加入二氧化硫,SO2+2H2S═3S↓+3H2O,氢离子浓度减小;
④硫化氢和硫酸铜反应生成硫化铜黑色沉淀同时生成硫酸,H2S+CuCl2═2HCl+CuS↓,盐酸是强电解质,氢硫酸是弱电解质,所以氢离子浓度增大;
故选C.
点评 本题考查了弱电解质的电离,明确物质间的反应结合生成物的性质即可解答,题目难度中等.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 如图 1 所示,若铜中含有杂质银,可形成原电池,且铜作负极 | |
| B. | 如图 2 所示,当有 0.1 mol 电子转移时,有 0.1 mol Cu2O 生成 | |
| C. | 基于绿色化学理念设计的制取 Cu2O 的电解池如图 2 所示,铜电极发生还原反应 | |
| D. | 若图 3 所示的装置中发生 Cu+2Fe3+═Cu2++2Fe2+的反应,则 X 极是负极,Y 极的材料可 以是铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钴元素的相对原子质量是60 | B. | 钴的一种同位素相对原子质量是60 | ||
| C. | 钴元素的质量为60 | D. | 钴的一种同位素的质量数为60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
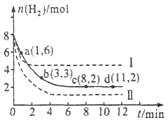 工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑤ | C. | ④⑥ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
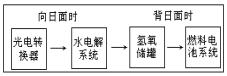 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )| A. | 该能量转化系统中的水也是可能循环的 | |
| B. | 燃料电池系统产生的能量实际上来自于水 | |
| C. | 水电解系统中的阳极有O2放出 | |
| D. | 燃料电池放电时的负极反应:H2+2OH--2e-=2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com