
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为()
A. 10mol B. 11mol C. 12mol D. 13mol
考点: 氧化还原反应的电子转移数目计算.
专题: 压轴题;氧化还原反应专题.
分析: 2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O中,Cu元素的化合价由+2价降低为+1价,I元素的化合价由+5价降低为0,I元素的化合价由﹣1价升高到0,以此来计算.
解答: 解:由2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+ 12H2O可知,
12H2O可知,
Cu(IO3)2中,Cu元素的化合价由+2价降低为+1价,I元素的化合价由+5价降低为0,
则Cu(IO3)2为氧化剂,
所以1mol氧化剂在反应中得到的电子为1mol×(2﹣1)+2mol×(5﹣0)=11mol,
故选B.
点评: 本题考查氧化还原反应中转移电子数目的计算,明确反应中元素的化合价变化是解答本题的关键,注意CuI中Cu为+1价为学生解答的易错点,题目难度中等.


科目:高中化学 来源: 题型:
欲配制100mL 1.0mol•L﹣1Na2SO4溶液,正确的方法是()
①将14.2g Na2SO4溶于100mL水中
②将32.2gNa2SO4•10H2O溶于少量水 中,再用水稀释至100mL
③将20mL 5.0mol•L﹣1Na2SO4溶液用水稀释至100mL.
A. ①② B. ②③ C. ①③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
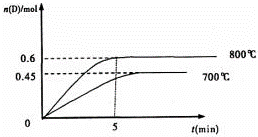
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)⇌C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:
(1)800℃时.0﹣5min内,以B表示的平均反应速率为 .
(2)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3 )若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= 反应为 填吸热或放热)
)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= 反应为 填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,
n(D)=0.9mol,则此时该反应向 填“向正反应方向”“向逆反应方向”或“处于平衡状态”).
查看答案和解析>>
科目:高中化学 来源: 题型:
提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法是()
A. 加入过量的碳酸钠溶液,过滤、除去沉淀,溶液中补加适量硝酸
B. 加入过量的碳酸钾溶液,过滤、除去沉淀,溶液中补加适量硝酸
C. 加入过量的硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D. 加入过量的硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向10mL 0.1mol•L﹣1NaOH溶液中逐滴加入0.1mol•L﹣1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是()
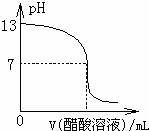
A. pH=7时,所加醋酸溶液的体积为10mL
B. pH<7时,溶液中:c(CH3COO﹣)>c(Na+)
C. 7<pH<13时,溶液中:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. 继续滴加0.1 mol•L﹣1醋酸溶液,溶液pH可以变为1
查看答案和解析>>
科目:高中化学 来源: 题型:
某校文印室里有两台复印机长期工作着,使用和操作复印机的师傅,时常感到身体有不适的现象.一天,一位学生知道后,查阅了相关资料,了解到复印机工作时易产生臭氧,臭氧浓度过高时,对人体有害.臭氧具有强氧化性,可以使湿润的碘化钾淀粉试纸变蓝,其中臭氧部分转化为氧气.
(1)写出并配平发生反应的离子方程式 ;
(2)该反应的氧化剂是 ,还原产物是 ;
(3)反应中1mol臭氧 (填“得到”或“失去”)2mol电子.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中错误的是( )
|
| A. | 从1L 1mol•L﹣1的NaCl溶液中取出10mL,其浓度仍是1mol•L﹣1 |
|
| B. | 制成0.5L 10mol•L﹣1的盐酸,需标准状况下氯化氢气体112L |
|
| C. | 0.5L 2mol•L﹣1 BaCl2溶液中,Ba2+和Cl﹣总数为3×6.02×1023 |
|
| D. | 10g 98%硫酸(密度为1.84g•cm﹣3)与10mL 18.4 mol•L﹣1硫酸的浓度是不同的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com