

分析 原料气中的一些物质能使催化剂中毒,故要通过净化除去,氨合成塔中的反应是在高压下进行的,混合气体经压缩后,可以增大反应物的浓度,并且压有利于提高原料的转化率,沉淀池中发生反应的离子方程式:Na++H2O+NH3+CO2=NaHCO3↓+NH4+,析出的固体是溶解度较小的碳酸氢钠,在沉淀池中还有氯化钠和氯化铵,氨气和二氧化碳在加热加压条件下可以得到尿素,
(1)原料气中的一些物质能使催化剂中毒,制备合成塔的材料需要承受较高的压力;
(2)增大反应物的浓度,可以提高反应的速率,高压有利于提高原料的转化率,循环使用某些原料可提高生产效益;
(3)①沉淀池中析出的固体是溶解度较小的碳酸氢钠;
②氨气和二氧化碳在加热加压条件下可以得到尿素;
(4)在沉淀池中还有氯化钠和氯化铵,低温下氯化铵可以结晶析出,但是氯化钠不能,铵根离子水解显示酸性;
(5)根据相关反应结合元素守恒,得到关系式为:C-2H2-$\frac{4}{3}$NH3-$\frac{2}{3}$[CO(NH2)2],据此计算即可.
解答 解:(1)原料气中的一些物质能使催化剂中毒,故要通过净化除去,氨合成塔中的反应是在高压下进行的,制备合成塔的材料需要承受较高的压力,所以普通的碳素钢不能制成该合成塔,故答案为:防止催化剂中毒影响催化活性;不能;
(2)混合气体经压缩后,可以增大反应物的浓度,提高反应的速率,由于合成氨的反应是气体分子数减少的反应,所以高压有利于提高原料的转化率,循环使用某些原料可提高生产效益,能循环利用的物质是N2、CO2、H2;故答案为:提高反应速率和转化率;N2、CO2、H2;
(3)①沉淀池中析出的固体是溶解度较小的碳酸氢钠,发生反应的离子方程式:Na++H2O+NH3+CO2=NaHCO3↓+NH4+;故答案为:Na++H2O+NH3+CO2=NaHCO3↓+NH4+;
②氨气和二氧化碳在加热加压条件下可以得到尿素,生产尿素的化学方程式为:2NH3+CO2$\frac{\underline{\;加热加压\;}}{\;}$[CO(NH2)2]+H2O,故答案为:2NH3+CO2$\frac{\underline{\;加热加压\;}}{\;}$[CO(NH2)2]+H2O;
(4)在沉淀池中还有氯化钠和氯化铵,低温下氯化铵可以结晶析出,但是氯化钠不能,所以低温下氯化铵的溶解度很可能小于氯化钠,NH4C1是一种氮肥,但铵根离子水解显示酸性,所以长期施用易使土壤酸化,离子方程式表示为:NH4++H2O?H++NH3•H2O;故答案为:小于;NH4++H2O?H++NH3•H2O;
(5)根据相关反应结合元素守恒,得到关系式为:C-2H2-$\frac{4}{3}$NH3-$\frac{2}{3}$[CO(NH2)2],得到n(C)=$\frac{1000×a%}{12}$,所以尿素的物质的量是)=$\frac{2}{3}$×$\frac{1000×a%}{12}$
×b%×c%,所以质量为:$\frac{2}{3}$×$\frac{1000×a%}{12}$×b%×c%×60g=$\frac{0.01abc}{3}$g,故答案为:$\frac{0.01abc}{3}$.
点评 本题考查了纯碱的工业制法,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力,明确合成原理为解答关键.


科目:高中化学 来源: 题型:实验题
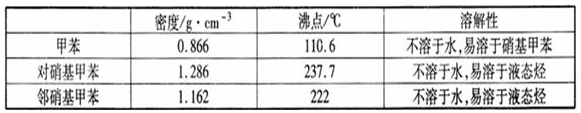
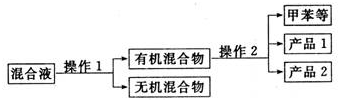
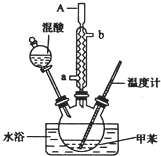 一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:
一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多 | |
| B. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(g)△H=-1256 kJ•mol-1,可知乙炔的燃烧热为1256 kJ•mol-1 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 molH2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量 | |
| B. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| C. | 若X表示反应时间,则Y表示的可能是混合气体的密度 | |
| D. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H3=-0.33 kJ/mol | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | △H3<0,单斜硫比正交硫稳定 | |
| D. | △H3>0,单斜硫比正交硫稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2 | B. | Q1=$\frac{1}{2}$Q2 | C. | Q1<$\frac{1}{2}$Q2 | D. | Q1>$\frac{1}{2}$Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/°C | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
| A. | 若500℃时进行反应①,则CO2转化率为50% | |
| B. | 900℃进行反应③H2(g)+CO2(g)?H2O(g)+CO(g),其平衡常数K3为=1.50 | |
| C. | 反应①的焓变△H>0,反应②的焓变△H<0 | |
| D. | 反应①平衡体系中通入CO2,在温度不变的条件下,平衡正向移动,达到新平衡时CO2的转化率比原平衡小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
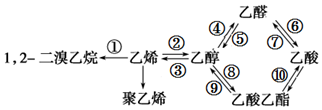
| A. | 反应①是加成反应,产物的结构简式 CH3CHBr2 | |
| B. | 反应②④⑥是氧化反应,其中④是去氢氧化 | |
| C. | 反应⑦⑧⑨⑩是取代反应,其中⑧是酯化反应 | |
| D. | ③是消去反应,反应的副产物中有SO2气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com