
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:

己知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25°C和95℃下溶解度分别为0.3g和6.9g。

i制备产品:将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________________________。
(2)在本实验中,三颈烧瓶最合适的容积__________(填字母)。
A. 50mL B. 100mL C. 200mL D. 250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是____________________________________。
ii分离产品:该同学设计如下流程分离粗产品苯甲酸和回收甲苯

(3)含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是______________;操作Ⅰ的名称是___________。
iii纯度测定
(4)称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH溶滴定(与苯甲酸恰好完全反应).重复三次,平均每次消耗KOH溶液的体积23.00mL。样品中苯甲酸纯度为_______。
(5)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物。应采用___________法对样品提纯。
【答案】a 平衡压强,使甲苯顺利滴入三颈烧瓶 B 便于控制温度和使容器受热均匀 蒸馏 分液 92% 重结晶
【解析】
(1)根据逆流的冷却的效率高的原理可知,进水口应在冷凝管的下方a处,支管连接了恒压滴液漏斗中的液体上、下方,使恒压滴液漏斗中的液体上、下方的压强相等,便于甲苯顺利滴入三颈烧瓶;
(2)本实验中用到的液体体积约为55mL,不超过容器的2/3,所以选择100mL的三颈烧瓶,故选B;沸水浴加热便于控制温度和使容器受热均匀;
(3)一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按流程分离出苯甲酸和回收未反应的甲苯;所以操作Ⅰ是分离出有机相甲苯,用分液方法得到;操作Ⅱ是蒸馏的方法控制甲苯沸点得到纯净的甲苯液体;
(4)苯甲酸与KOH反应为:![]() +KOH
+KOH![]() +H2O,可得苯甲酸与KOH的物质的量相等,n(KOH)=0.1000mol/L×0.023L=0.0023mol,苯甲酸的质量为:0.0023mol×122g/mol=0.2806g,称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,则25mL溶液中含有样品为0.305g,样品纯度=0.2806g/0.305g=92%;
+H2O,可得苯甲酸与KOH的物质的量相等,n(KOH)=0.1000mol/L×0.023L=0.0023mol,苯甲酸的质量为:0.0023mol×122g/mol=0.2806g,称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,则25mL溶液中含有样品为0.305g,样品纯度=0.2806g/0.305g=92%;
(5)分离溶解度差距较大的两种溶质通常采用重结晶的方法,答案为重结晶;
(1)根据逆流的冷却的效率高的原理可知,进水口应在冷凝管的下方a处,支管连接了恒压滴液漏斗中的液体上、下方,使恒压滴液漏斗中的液体上、下方的压强相等,便于甲苯顺利滴入三颈烧瓶,故答案为:a;平衡压强,便于甲苯顺利滴入三颈烧瓶;
(2)本实验中用到的液体体积约为55mL,不超过容器的2/3,所以选择100mL的三颈烧瓶,故选B;沸水浴加热便于控制温度和使容器受热均匀,故答案为:B;便于控制温度和使容器受热均匀;
(3)一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按流程分离出苯甲酸和回收未反应的甲苯;所以操作Ⅰ是分离出有机相甲苯,用分液方法得到;操作Ⅱ是蒸馏的方法控制甲苯沸点得到纯净的甲苯液体,故答案为:蒸馏;分液;
(4)苯甲酸与KOH反应为:![]() +KOH
+KOH![]() +H2O,可得苯甲酸与KOH的物质的量相等,n(KOH)=0.1000mol/L×0.023L=0.0023mol,苯甲酸的质量为:0.0023mol×122g/mol=0.2806g,称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,则25mL溶液中含有样品为0.305g,样品纯度=0.2806g/0.305g=92%;
+H2O,可得苯甲酸与KOH的物质的量相等,n(KOH)=0.1000mol/L×0.023L=0.0023mol,苯甲酸的质量为:0.0023mol×122g/mol=0.2806g,称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,则25mL溶液中含有样品为0.305g,样品纯度=0.2806g/0.305g=92%;
(5)分离溶解度差距较大的两种溶质通常采用重结晶的方法,答案为重结晶;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列变化过程不能用勒夏特列原理解释的是:
A. 热的纯碱溶液洗涤油渍效果较好 B. 将AlCl3溶液蒸干、灼烧,得到Al2O3固体
C. 实验室配制FeCl3溶液时滴入盐酸 D. 制硫酸工业中,采用500℃左右氧化SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某些植物树叶提取的挥发油中含有下列主要成分:

(1)B、C中互不相同官能团的名称分别为:_______、_______
(2)有关A、B、C三种物质的说法正确的是_______ (填序号)
a.均能发生加聚反应 b.只有B能与FeCl3发生显色反应
c.均不能与碳酸钠溶液反应 d.只有C能发生银镜反应
(3)A中苯环上的一卤代物的同分异构体的数目为________
(4)0.5mol B与足量的溴水充分反应,消耗_______ mol单质溴,其反应类型为:_______、______。
(5)己知: R1CH=CHR2![]() R1COOH+R2COOH.
R1COOH+R2COOH.
有机物C9H8O发生如下反应:
C9H8O ![]()
![]()
则C9H8O的结构简式为_______________。
(6)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,错误的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 含有5个碳原子的饱和链烃,其一氯取代物共有8种
C. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
D. 菲的结构简式为 ,可有5种一氯取代物
,可有5种一氯取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)梯恩梯(TNT)结构简式为____________________________。
(2)![]() 中含有的官能团的名称为_______________。
中含有的官能团的名称为_______________。
(3)戊烷的某种同分异构体只有一种一氯代物,试书写它的结构简式________________________。
(4)某炔烃和氢气充分加成生成2,2,5-三甲基己烷,该炔烃的结构简式是________,名称是____________。
(5)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为__________________
(6)分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_______________。
(7)键线式![]() 表示的分子式为____________,名称是______________________。
表示的分子式为____________,名称是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】髙分子聚合物Nomex芳纶(G)耐热性好、强度髙,是一种很好的绝热材料和阻燃纤维,下图是 Nomex芳纶的合成路线图:

(1)A的名称为___________;④的反应类型为___________;G的结构简式为___________。
(2)写出反应②的化学方程式:___________。
(3)B的芳香族同分异构体H具有三种含氧官能团,其各自的特征反应如下:
a.遇FeCl3溶液显紫色;b.可以发生水解反应;c.可发生银镜反应
符合以上性质特点的H共有___________种。
(4)下列有关F的说法正确的是___________(填字母序号)。
A.F的分子式为C14H12N2O3 B.F中只含有氨基和羧基两种官能团
C.F的核磁共振氢谱有11组吸收峰 D.F可以水解得到氨基酸
(5)聚氨基酸类物质以其无毒易降解特性广泛应用于药物载体,已知:CH3 CH2Cl+NH3![]() CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知28 g CuO和MgO的固体混合物与200 mL某H2SO4溶液恰好完全反应,将反应后的溶液小心蒸干,得到固体68 g。则原H2SO4溶液的物质的量浓度和原固体混合物中氧元素的质量分数分别是( )
A.2.5 mol·L-1 28.57%B.2.2 mol·L-1 23.07%
C.1.5 mol·L-1 24.55%D.2.5 mol·L-1 18.37%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组进行电解原理的实验探究,实验如下:一定温度下,以铜为电极,按如图所示装置电解饱和食盐水,通电2min。实验现象:接通电源30s内,阳极附近出现白色浑浊,之后变为橙黄色浑浊,此时测定溶液的pH约为10。结束后(温度不变),试管底部聚集大量红色沉淀,溶液仍为无色。

查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
下列说法错误的是( )
A. 反应结束后,最终溶液一定呈碱性
B. 反应过程中发生了沉淀转化,说明Ksp(CuOH)<Ksp (CuCl)
C. 阴极的电极反应式为2H2O+2e-=H2↑+2OH-
D. 电解过程中,Cl-移向阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能与电能可相互转化,根据下图回答问题。
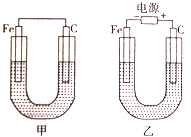
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的______棒,乙装置中的____________棒。(填“铁”或“碳”)
②乙装置中阳极上发生的电极反应式为________________________。
(2)若两装置中均为饱和NaCl溶液:
①甲装置中碳棒上电极反应属于_________________(填“氧化反应”或“还原反应”)。
②乙装置中反应的化学方程式为 __________________。
③若乙装置转移0.1mole-后停止实验,且溶液体积为1L,则溶液混匀后的c(OH-)=_____。(不考虑所生成气体在溶液中的溶解)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com