
【题目】处理含氰![]() 废水可以用以下两种方法:
废水可以用以下两种方法:
Ⅰ:![]() (未配平),其中A为参与大气循环的气体
(未配平),其中A为参与大气循环的气体
Ⅱ:①![]() (未配平)
(未配平)
②![]() 下列说法正确的是( )
下列说法正确的是( )
A. ![]() 和
和![]() 的电子式分别为
的电子式分别为![]()
![]()
B. 方法Ⅰ中,每生成![]() ,转移
,转移![]() 个电子
个电子
C. 方法Ⅱ中,![]() 是反应②的氧化产物
是反应②的氧化产物
D. 方法Ⅱ的反应①中,![]() 与
与![]() 的物质的量之比为1∶1
的物质的量之比为1∶1
【答案】D
【解析】
A、![]() 和
和![]() 的电子式未标出多带的电荷,故错误;
的电子式未标出多带的电荷,故错误;
B、配平方程:![]() ,C由+2价变成+4价,N由-3价变成0价,或从Cl的角度来分析;
,C由+2价变成+4价,N由-3价变成0价,或从Cl的角度来分析;
C、反应![]() 中,CO2中碳元素的化合价不变;
中,CO2中碳元素的化合价不变;
D、根据得失电子守恒CN-与Cl2按物质的量的比为1:1.
A、![]() 和
和![]() 的电子式应该为:
的电子式应该为:![]() 、
、![]() ,故A错误;
,故A错误;
B、配平后:![]() ,氯从+1价变成-1价,因此每生成
,氯从+1价变成-1价,因此每生成![]() ,转移
,转移![]() 个电子,故B错误;
个电子,故B错误;
C、反应![]() 中,碳的化合价没有发生变化,因此,二氧化碳既不是氧化产物也不是还原产物,故C错误;
中,碳的化合价没有发生变化,因此,二氧化碳既不是氧化产物也不是还原产物,故C错误;
D、CN-+2OH-+Cl2→OCN-+2Cl-+H2O中碳由+2价变成+4价,氯气中的氯元素由0价变成-1价,根据得失电子守恒CN-与Cl2按物质的量为1:1,故D正确。
故选D。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。所发生的转化过程为CH3CH2CH2CH2OH![]() CH3CH2CH2CHO。
CH3CH2CH2CHO。

反应物和产物的相关物理性质如表所示。
性质 | 沸点/℃ | 密度/g·cm-3 | 水中溶解性 |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以上的馏分。将馏出物倒入分液漏斗中,分去水层,将有机层干燥后蒸馏,收集75~77℃馏分,产量为2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加入浓硫酸中,说明理由:___________。
(2)加入沸石的作用是___________,若加热后发现未加入沸石,应采取的正确措施是___________。
(3)上述装置图中,B仪器的名称是____,D仪器的名称是_______。
(4)将正丁醛粗产品置于分液漏斗中分离水时,水在______(填“上”或“下”)层。
(5)反应温度应保持在90~95℃,其原因是______________________。
(6)本实验中,正丁醛的产率为_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe(NO3)3、Cu(NO3)2、HNO3的某种稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。下列说法错误的是( )
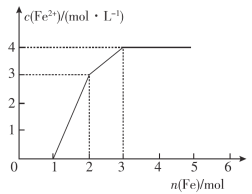
A.横轴0~1:Fe+NO![]() +4H+==Fe3++NO↑+2H2O
+4H+==Fe3++NO↑+2H2O
B.横轴1~2:Fe+2Fe3+=3Fe2+
C.横轴2~3:Fe+Cu2+=Fe2++Cu
D.原溶液中三种溶质浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究了铜片与![]() 反应的速率,实现现象记录如下表。
反应的速率,实现现象记录如下表。
实验 | 时间段 | 现象 |
|
| 铜片表面出现极少气泡 |
| 铜片表面产生较多气泡,溶液呈很浅的蓝色 | |
| 铜片表面均匀冒出大量气泡 | |
| 铜片表面产生较少气泡,溶液蓝色明显变深,液面上方呈浅棕色 |
为探究影响该反应速率的主要因素,小组进行如下实验。
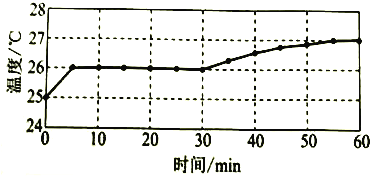
实验I:监测上述反应过程中溶液温度的变化,所得曲线如下图。
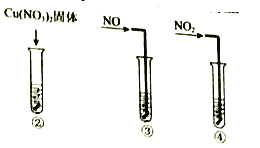
实验II:②-④试管中加入大小、形状相同的铜片和相同体积、 ![]() 。结果显示:
。结果显示:![]() 对
对![]() 和
和![]() 反应速率的影响均不明显,
反应速率的影响均不明显,![]() 能明显加快该反应的速率。
能明显加快该反应的速率。
实验III:在试管中加入铜片和![]() ,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有
,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有![]() 。
。
(1)根据表格中的现象,描述该反应的速率随时间的变化情况:____________。
(2)实验![]() 的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
(3)实验II的目的是:__________
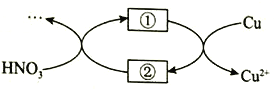
(4)小组同学查阅资料后推测:该反应由于生成某中间产物而加快了反应速率。请结合实验II、III,在下图方框内填入相应的微粒符号①____②_____,以补全催化机理。
(5)为验证(4)中猜想,还需补充一个实验:__________(请写出操作和现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。
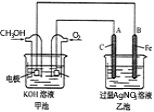
(1)甲电池是_________装置,乙池是_________装置。
(2)通入CH3OH的电极名称是_______,A(石墨)电极的名称是________。
(3)通入O2的电极的电极反应式是________________________。B(Fe)电极的电极反应式为___________________________。
(4)乙池中反应的化学方程式为___________________________。
(5)当乙池中B(Fe)极的质量增加5.40g时,甲池中理论上消耗O2_____mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比法是常见的研究物质性质的方法之一,可用来预测很多物质的性质,但类比是相对的,必须遵循客观实际,下列说法中正确的是( )
A. ![]() 通入
通入![]() 溶液中没有现象,
溶液中没有现象,![]() 通入
通入![]() 溶液中也无明显现象
溶液中也无明显现象
B. ![]() 与
与![]() 会因为水解相互促进而完全反应生成
会因为水解相互促进而完全反应生成![]() 和
和![]() ,
,![]() 与
与![]() 也可以水解相互促进至完全反应生成
也可以水解相互促进至完全反应生成![]() 和
和![]()
C. 偏铝酸是一元酸,因此,![]() 也是一元酸
也是一元酸
D. ![]() 在标准状况下为气体,所以
在标准状况下为气体,所以![]() 在标准状况下同样为气体
在标准状况下同样为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是化工合成中最重要的镍源,在实验室中模拟工业上利用金属镍废料(含镍、铁、铝)生产氯化镍晶体
是化工合成中最重要的镍源,在实验室中模拟工业上利用金属镍废料(含镍、铁、铝)生产氯化镍晶体![]() 流程如下:
流程如下:

下表列出了相关金属离子生产氢氧化物沉淀的pH:
氢氧化物 |
|
|
|
|
开始沉淀的pH | 7.6 | 2.7 | 7.1 | 3.7 |
沉淀完全的pH | 9.6 | 3.7 | 9.2 | 4.7 |
回答下列问题:
(1)加入![]() 氧化时发生反应的离子方程式为________________________,调pH的范围为____________,若调
氧化时发生反应的离子方程式为________________________,调pH的范围为____________,若调![]() ,则溶液中
,则溶液中![]() _______________。(已知
_______________。(已知![]() ,
,![]() )
)
(2)滤液A的溶质主要是______________________。
(3)操作①的实验方法依次是_____________、_____________、过滤、洗涤、干燥,操作②的实验方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①NaOH,②H2SO4,③CH3COOH,④NaCl,⑤CH3COONa,⑥NH4Cl,⑦CH3COONH4,⑧NH4HSO4,⑨NH3H2O,请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为______________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH﹣)=_____;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_____。
(3)已知水存在如下平衡:H2O+H2O![]() H3O++OH﹣△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_____。
H3O++OH﹣△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_____。
A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃[其中c(H+)=1×10﹣6mol/L] D.向水中加入NH4Cl固体
(4)若浓度均为0.1mol/L、等体积的NaOH和NH3H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 m_____n(填“<”、“>”或“=”)。
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_____。
(6)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com