
| ��һ������ | �縺�� | �ȶ��� | ���� |
| N��O | C��N | H2S��H2O | H2SO4��HClO4 |
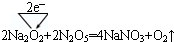 ��
�� ���� ��1�����ݵ��Ӳ���=������������������=������������N�Ļ�̬ԭ�Ӻ���δ�ɶԵ��Ӵ���2p�����Sԭ�Ӻ�����ӻ�̬�Ų�ʽΪ1s22s22p63s22p4��
��2��ͬ���ڴ����ҵ�һ�����������������ڵ�IIA����A����������ԣ�
ͬ���ڴ����ҵ縺������Ԫ�صķǽ�����Խǿ����Ӧ���⻯����ȶ���Խǿ��
Ԫ�صķǽ�����Խǿ����Ӧ������������ˮ���������Խǿ��
��3���Ǽ��Թ��ۼ�Ϊͬ�ַǽ���Ԫ�ص�ԭ�Ӽ��γɹ��ۼ������Թ��ۼ����ɲ�ͬ�ַǽ���Ԫ�ص�ԭ�Ӽ����γɵĹ��ۼ���
��4����ԭ�ӷǽ�����ǿ��������֮�������γ������ʹ��е����߶�����Һ����1mol����NH3������O2��Ӧ����ˮ��������һ�����壬��Ӧ����һ��������ˮ�����ݵ���ת�Ƽ��㷴Ӧ�İ�������ϻ�ѧ����ʽ������ϵ���㷴Ӧ���ȣ����Ȼ�ѧ����ʽ��д����д����
��5�����ݶ�����̼��Na2O2�ķ�Ӧ��֪���÷�Ӧ������NaNO3��O2����������ԭ��Ӧ�У����ϼ�����Ԫ��ʧ���ӣ����ϼ۽���Ԫ�صõ����ӣ���ʧ��������ȼ�Ϊת�Ƶ�������
��� �⣺��1��NԪ��λ��Ԫ�����ڱ��ڶ����ڵڢ�A�壬N�Ļ�̬ԭ�Ӻ���δ�ɶԵ��Ӵ���2p�������3��δ�ɶԵ��ӣ�Sԭ�Ӻ��������Ϊ16��������ӻ�̬�Ų�ʽΪ1s22s22p63s23p4��
�ʴ�Ϊ��������A��3��1s22s22p63s23p4��
��2��ͬ���ڴ����ҵ�һ��������������A����������ԣ����Ե�һ������N��O��
ͬ���ڴ����ҵ縺���������Ե縺��C��N��
ͬ����Ԫ�ش��ϵ��·ǽ������������ǽ����ԣ�O��S��Ԫ�صķǽ�����Խǿ����Ӧ���⻯����ȶ���Խǿ����̬�⻯���ȶ��ԣ�H2S��H2O��
ͬ����Ԫ�ش�����Ԫ�طǽ���������ǿ���ǽ����ԣ�Cl��S��Ԫ�طǽ�����Խǿ����Ӧ������������ˮ���������Խǿ�����ԣ�H2SO4��HClO4��
�ʴ�Ϊ������������������
��3��H2O2��N2H4��C2H2��C2H4��C2H6��C6H6�мȺ����Լ��ֺ��Ǽ��Լ���
�ʴ�Ϊ��H2O2��N2H4��C2H2��C2H4��C2H6��C6H6����ѡ��һ��
��4����ԭ�ӷǽ�����ǿ��������֮�������γ����������Ĵ���ʹ�ð������Ӽ�������������ǿ���е��������ߣ���Һ������1mol����NH3������O2��Ӧ����ˮ��������һ�����壬4NH3��g��+5O2��g��=4NO��g��+6H2O��g������Ӧ������4mol������Ӧ����ת��20mol��ÿת��1mol e-���ų�akJ��������Ӧ4mol��������4a kJ��д���Ȼ�ѧ����ʽΪ��4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=-4a kJ/mol��
�ʴ�Ϊ��NH3���Ӽ����γɷ��Ӽ����������Ĵ���ʹ�ð������Ӽ�������������ǿ���е��������ߣ���Һ����4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=-4a kJ/mol��
��5����Na2O2��N2O5�ķ�Ӧ�У�����NaNO3��O2�����ϼ�������=���ϼ۽�����=ת�Ƶ�����=2������ת�����Ϊ��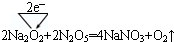 ���ʴ�Ϊ��
���ʴ�Ϊ��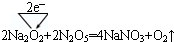 ��
��
���� ������Ҫ�����˺�������Ų���Ԫ�����ʵıȽϡ���ѧ���Լ�������ԭ��Ӧ���ѶȲ���ע���Ӧ֪ʶ�����ã�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ�� | 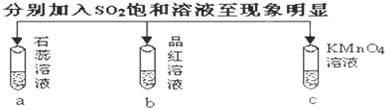 | |||
| ��¼ | A | ��ɫ | ��ɫ | ��ɫ |
| B | ��ɫ | ��ɫ | ��ɫ | |
| C | ��ɫ | ��ɫ | ��ɫ | |
| D | ��ɫ | ��ɫ | ��ɫ | |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
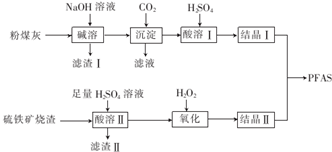
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
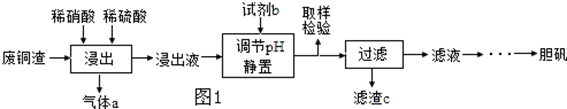
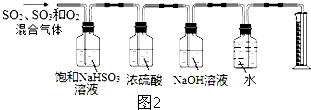
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
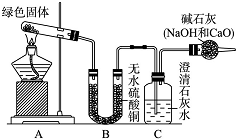 ͭ�����ã����������һ����ɫ���壬Ϊ�˽�ͭ�ڿ����еĸ�ʴ�����ij��ѧ��ȤС���ռ�����ͭ���������ɫ�������̽��������������Ϻ������ɫ���ʿ�����ͭ��̼���Σ�
ͭ�����ã����������һ����ɫ���壬Ϊ�˽�ͭ�ڿ����еĸ�ʴ�����ij��ѧ��ȤС���ռ�����ͭ���������ɫ�������̽��������������Ϻ������ɫ���ʿ�����ͭ��̼���Σ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ö����ЧӦ����NaCl��Һ��KCl��Һ | |
| B�� | ��ij��Һ�м���BaCl2��Һ���ְ�ɫ�����������Һ�п϶���SO42- | |
| C�� | ��KSCN��Һ����FeCl2��Һ��Fe2��SO4��3��Һ | |
| D�� | ����ɫ��Ӧ�ɼ����NaCl��KCl��Na2SO4�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.3��10 -1 | 1.7��10 -5 | 6.2��10 -10 | K1=4.3��10-7 K2=5.6��10-11 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CCl4����CH4�Ƶã�����ȡ��ˮ�еĵ� | |
| B�� | �Ҵ������ụΪͬ���칹�� | |
| C�� | ���ȼ���ֻ��һ�ֽṹ | |
| D�� | �����ʵ������Ҵ�����ϩ��ȫȼ��ʱ����������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com