
【题目】下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:

回答下列问题:
(1)A是:_____,C是:_____,L是:______,I是:____(填化学式)。
(2)写出反应①②③的化学反应方程式:
①:____________________________________;
②:____________________________________;
③:____________________________________;
【答案】Na Cl2 HCl CO2 2Na+2H2O=2NaOH+H2↑ 2Na2O2+2H2O=4NaOH+O2↑ 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
【解析】
焰色反应为黄色的单质是钠,钠元素在自然界主要以氯化钠的形式存在,淡黄色固体是过氧化钠,常见的无色液体是水,造成温室效应的“元凶”是二氧化碳。因此,A是钠,B是氧气,C是氯气,D是氢氧化钠,E是氧化钠,F是过氧化钠,G是氯化钠,H是水,I是二氧化碳,J是碳酸氢钠,K是碳酸钠,L是盐酸。
(1)A是钠,化学式为Na,C是氯气,化学式为Cl2,L是氯化氢,化学式为HCl,I是二氧化碳,化学式为CO2 ;
(2)①是钠与水的反应,化学方程式为:2Na+2H2O=2NaOH+H2↑;
②是过氧化钠与水的反应,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;
③是碳酸氢钠的受热分解,化学方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O ;
Na2CO3+CO2↑+H2O ;


科目:高中化学 来源: 题型:
【题目】A、B 两种元素为同一族第三周期和第四周期元素,若 A 元素的原子序数为 x,则 B 元素的原子序数可能为( )
①x+2 ②x+8 ③x+18 ④x+32
A.③B.②C.②③D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)钛原子的价电子排布式为______________________,TiCl4沸点136℃,熔点-25℃,晶体类型为___________晶体。
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________。
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型_________________;一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是______________________,理由是______________________。
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则钴原子半径为___________mm,钴的相对原子质量可表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24mL浓度为0.05mol·L-1的Na2SO3溶液,恰好与20mL浓度为0.02mol·L-1的K2Cr2O7,溶液完全反应,则元素Cr在被还原的产物中的化合价是(已知Na2SO3被氧化为Na2SO4)
A.+6B.+3C.+2D.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图所示为常见玻璃仪器的部分结构:

(1)请写出所列仪器的名称:A__________,B____________;C_____________;
(2)仪器 B 使用前必须______________________。
(3)仪器 B 上标记有__________________(填序号);
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
II. 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。

根据上述实验和图中数据:
(1)该废水中一定不含有的离子有________________(填离子符号);
(2)写出A→B过程中发生反应的离子方程式:_________________;
(3)该废水中,c(Al3+)=________________________;
(4)①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要________(填仪器名称)。
②下列操作使所配溶液浓度偏大的是(填写字母)________。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是
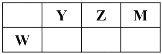
A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z
C. 仅由X、Y、Z三种元素形成的化合物中不可能含离子键
D. WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有未知浓度的Ba(OH)2和NaOH混合溶液,量取四份该溶液分别通入等量的CO2(已折算成标准状况下的体积,不考虑CO2在水中的溶解),生成沉淀的物质的量如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
CO2体积(mL) | 2352 | 2352 | 2352 | 2352 |
样品体积(mL) | 20.0 | 30.0 | 40.0 | 50.0 |
沉淀物质的量(×10-2mol) | 1.50 | 4.50 | 6.00 | 7.50 |
(1)该混合溶液中Ba(OH)2的物质的量浓度=_____________。
(2)实验Ⅲ最后所得溶液中碳酸钠的物质的量=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融NaNO3可制作燃料电池,其原理如图,下列判断正确的是

A. 石墨电极Ⅱ为电池负极
B. 电池中NO3-从石墨电极I向石墨电极Ⅱ作定向移动
C. 石墨I电极发生的电极反应为NO2+NO3--e-=N2O5
D. 每消耗1 mol NO2转移电子2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) ![]() a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是____________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为____________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?________,其理由是___________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是____________(稀有气体不参与反应)。
A.2 mol X、1 mol Y、1 mol Ar
B.a mol Z、1 mol W
C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W
D.2 mol X、1 mol Y、1 mol Z
(5)X的转化率α=____________(用含Q、Q1的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com