
| A. | 离子化合物中不可能含有共价键 | |
| B. | 晶体中一定存在化学键 | |
| C. | 碱性氧化物一定是金属氧化物 | |
| D. | 直径介于1-10nm之间的微粒称为胶体 |
分析 A.离子化合物中可存在共价键;
B.稀有气体的晶体中不存在化学键;
C.碱性氧化物一定含金属元素;
D.胶体为混合物.
解答 解:A.离子化合物中可存在共价键,如离子化合物NaOH中含O-H共价键,故A错误;
B.稀有气体的晶体中不存在化学键,只存在分子间作用力,故B错误;
C.碱性氧化物一定含金属元素,则一定为金属氧化物,但金属氧化物不一定为碱性氧化物,故C正确;
D.胶体为混合物,则分散系中分散质的直径介于1-10nm之间的为胶体,故D错误;
故选C.
点评 本题考查化学键及胶体、物质分类等,为高频考点,把握化学键的形成、物质类别为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是SiO2 | |
| B. | 利用SiO2与碳反应制粗硅 | |
| C. | 常温下硅性质稳定,不与氯气、强酸、强碱溶液等起反应 | |
| D. | SiO2性质稳定,常温下不与任何物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
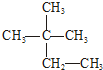 ③C60 ④氯气 ⑤
③C60 ④氯气 ⑤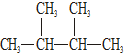 ⑥液氯 ⑦石墨 ⑧${\;}_{17}^{35}$Cl.
⑥液氯 ⑦石墨 ⑧${\;}_{17}^{35}$Cl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa与足量O2反应,转移0.2nA个电子 | |
| B. | 1L0.1mol•L-1Na2S溶液中含有0.1nA个S2- | |
| C. | 常温下,44gCO2含有nA个C原子 | |
| D. | 标准状况下,22.4L的CCl4含有4nA个Cl原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO-3═Fe3++NO↑+2H2O | |
| C. | 溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 苯酚钠溶液中通入少量二氧化碳: -O-+CO2+H2O→ -O-+CO2+H2O→ -OH+HCO3- -OH+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③④⑥ | C. | ①②④⑥ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com