
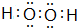 .
.分析 A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性,A的原子序数比B小,则B为N元素,A为H元素,X为NH3;D的简单阳离子与X具有相同电子数,D的简单阳离子为10e-结构,且D是同周期中简单离子半径最大的元素,则D为Na元素;E元素的原子最外层比次外层少两个电子,E的原子序数大于Na,则E有3个电子层,最外层电子数为6,则E为S元素;F的原子序数比E大且为短周期主族元素,则F是Cl元素;C、F两种元素的原子最外层共有13个电子,C原子最外层有6个电子,原子序数比Na小,则C为O元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性,A的原子序数比B小,则B为N元素,A为H元素,X为NH3;D的简单阳离子与X具有相同电子数,D的简单阳离子为10e-结构,且D是同周期中简单离子半径最大的元素,则D为Na元素;E元素的原子最外层比次外层少两个电子,E的原子序数大于Na,则E有3个电子层,最外层电子数为6,则E为S元素;F的原子序数比E大且为短周期主族元素,则F是Cl元素;C、F两种元素的原子最外层共有13个电子,C原子最外层有6个电子,原子序数比Na小,则C为O元素.
(1)F为Cl元素,在周期表中的位置:第三周期第ⅦA族,故答案为:第三周期第ⅦA族;
(2)所有元素中H原子半径最小,同周期自左而右原子半径减小,一般电子层越多原子半径越大,故六种元素原子半径由小到大的顺序为:Na>S>Cl>N>O>H,
故答案为:Na>S>Cl>N>O>H;
(3)O元素与Na形成的两种化合物中,其中一种物质含有两种类型的化学键,该物质为过氧化钠,属于离子化合物,故答案为:离子化合物;
(4)H、O两种元素能形成常温下为液态的两种化合物M和N,具有强氧化性的M为H2O2,电子式为 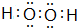 ,故答案为:
,故答案为: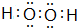 ;
;
(5)在上述元素最高价氧化物对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(6)H、N、O、Na、S中三种或四种元素能形成多种盐,其中水溶液呈碱性的有Na2SO3、NaClO等,故答案为:Na2SO3、NaClO.
点评 本题考查结构性质位置关系应用,气体X的水溶液呈碱性是推断元素的突破口,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 待测液中加入氯化钡溶液有白色沉淀生成,再加稀盐酸,沉淀不消失,则待测液中一定有硫酸根离子 | |
| B. | 用灼烧的方法可鉴别丝绸与棉布 | |
| C. | 无色溶液中加入Na2CO3溶液产生白色沉淀,则该无色溶液中含有Ca2+ | |
| D. | 待测液中加入AgNO3溶液,有白色沉淀生成,则待测液中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 |  | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色溶液 | |
| C | 无色 | 无色 | 白色沉淀 | 无色溶液 | |
| D | 红色 | 无色 | 白色沉淀 | 白色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在共价化合物分子中,一定不存在离子键 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 在离子化合物里,只存在离子键,没有共价键 | |
| D. | 由不同元素组成的多原子分子里,一定只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 所有元素中电负性最大的元素 |
| X | L层p电子数比s电子数多2个 |
| Y | 其最高价氧化物呈两性 |
| Z | L层有三个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com