
 表示的分子式C6H14;名称是2甲基-戊烷.
表示的分子式C6H14;名称是2甲基-戊烷. 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.分析 (1)根据该有机物键线式写出分子式,该有机物为烷烃,根据烷烃的命名原则进行解答;
(2)根据官能团的概念及该有机物的结构简式写出其含有的官能团名称;
(3)按照主链由多到少的顺序写出丁基可能的结构简式;
(4)根据蒸馏操作装置写出使用的玻璃仪器名称.
解答 解:(1)键线式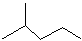
故答案为:C6H14;2-甲基戊烷;
(2)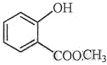 中含有的官能团有:羟基、酯基,
中含有的官能团有:羟基、酯基,
故答案为:羟基、酯基;
(3)根据碳原子数目由多到少的顺序,丁基的结构简式为:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)2,-C(CH3)3,
故答案为:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)2,-C(CH3)3;
(4)含有杂质的工业乙醇的蒸馏装置中,需要使用的玻璃仪器为:酒精灯、蒸馏瓶、温度计、冷凝管、尾接管、锥形瓶,还缺少温度计和冷凝管,
故答案为:蒸馏瓶;温度计;冷凝管;锥形瓶.
点评 本题考查了有机物结构、命名及蒸馏操作相关知识,题目难度中等,注意掌握常见有机物结构与性质,明确常见有机物的命名原则及蒸馏操作中仪器的选用方法.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4nb}{m{N}_{A}}$L | B. | $\frac{22.4mb}{n{N}_{A}}$ L | C. | $\frac{22.4n{N}_{A}}{mb}$ L | D. | $\frac{nb{N}_{A}}{22.4m}$ L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


 .
. B、
B、 C、
C、 D、
D、
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释100倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸的pH=3,则1.0×10-8mol/L盐酸的pH=8 | |
| D. | 某温度下水的离子积为1×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热水瓶胆中的水垢可以用食醋除去 | |
| B. | 福尔马林用于标本的制作是利用了使蛋白质变性的性质 | |
| C. | 含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 | |
| D. | 在清理厕所时洁厕灵和84消毒液不能混用,否则可能发生中毒现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | -1940 kJ•mol-1 | B. | 1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | 485 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是负极,氧化银是正极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH逐渐增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com