
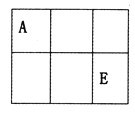
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
(1)C在元素周期表中的位置为________,其离子的结构示意图为________________。
(2)AE2的分子式为______________。
(3)C、E、F的单质沸点最低的是__________(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___________(填离子符号)。
(5)实验室制取F2气体的离子方程式为____________。
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为_____________________。
【答案】(1)第二周期第ⅥA族![]()
(2)CS2(3)O2 (4)S2->Cl>O2->Al3+
(5)MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O(6)2NH3H2O+3H2O2=N2↑+8H2O
【解析】试题分析:由题中所给信息可知,A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A能与氧元素形成两种无色气体,则A为C元素;C为O元素;D为Al元素,且图中给出了A和E在元素周期表中的相对位置,则B为N;E是S;F为Cl
(1)C为氧元素,在周期表中的位置为第二周期第ⅥA族;其离子结构示意图为![]() ;
;
(2)A为C,E为S,因此AE2的分子式为CS2
(3)由题元素的非金属性越强,其单质的沸点越低,氧,硫,氯中,非金属性:O>Cl>S,因此O2的沸点最低。
(4)具有相同的电子层结构的离子,核电荷数越大,原子核对核外电子的吸引能力越强,离子半径越小。具有不同电子层结构的离子,电子层数越多,离子半径越大。因此可得离子半径:S2->Cl>O2->Al3+
(5)实验室制取氯气使用二氧化锰和盐酸反应生成氯气,其离子方程式为MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
(6)B为N,其最简单的气态氢化物为NH3,反应方程式为NH3H2O+3H2O2=N2↑+8H2O


科目:高中化学 来源: 题型:
【题目】化学在生产和生活中有着重要的作用,下列有关说法不正确的是
A. 小苏打可用作糕点的膨化剂
B. “地沟油"经过加工处理可用来制肥皂
C. 多地花重金购买“雾霾消除车",从根本上缓解了雾霾问题
D. 装饰材料释放的苯、甲苯、甲醛等易挥发性物质会导致室内空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用直接加热氧化铝的方法冶炼得到铝
B.海水中含有钾元素,只需经过物理变化可以得到钾单质
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.高炉炼铁的过程是通过置换反应得到铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b分别连接直流电流正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各基态原子或离子的电子排布式正确的是 ( )
A. O2- 1s22s22p4 B. Ca 3d2
C. Fe 3d54s3 D. Si 1s22s22p63s23p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
B.二氧化碳和CaCl2溶液反应,生成白色沉淀
C.二氧化硅和烧碱溶液反应,使溶液的碱性一定减弱
D.在常温下,浓硫酸不与铜反应,是因为铜被钝化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com