
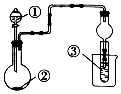
 利用如图装置进行下列实验,一定不能得出相关实验现象的是( )
利用如图装置进行下列实验,一定不能得出相关实验现象的是( )| 选项 | ① | ② | ③ | ④ |
| A | 醋酸水溶液 | 贝壳 | 澄清石灰水 | 先浑浊后澄清 |
| B | 稀盐酸 | 石灰石 | 饱和Na2CO3溶液 | 出现浑浊 |
| C | 浓盐酸 | 浓硫酸 | 石蕊溶液 | 出现红色 |
| D | 浓盐酸 | Na2CO3 | CaCl2溶液 | 先浑浊后澄清 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.醋酸与贝壳反应生成二氧化碳,二氧化碳与石灰水反应先生成沉淀后生成碳酸氢钙;
B.稀盐酸与石灰石反应生成二氧化碳,二氧化碳与饱和碳酸钠反应生成溶解度小的碳酸氢钠;
C.浓盐酸易挥发,与浓硫酸混合,逸出HCl,HCl遇石蕊变红;
D.浓盐酸与碳酸钠反应生成二氧化碳,二氧化碳与氯化钙不反应.
解答 解:A.醋酸与贝壳反应生成二氧化碳,二氧化碳与石灰水反应先生成沉淀后生成碳酸氢钙,可观察到先浑浊后澄清,故A正确;
B.稀盐酸与石灰石反应生成二氧化碳,二氧化碳与饱和碳酸钠反应生成溶解度小的碳酸氢钠,则观察到出现浑浊,故B正确;
C.浓盐酸易挥发,与浓硫酸混合,逸出HCl,HCl遇石蕊变红,则观察到出现红色,故C正确;
D.浓盐酸与碳酸钠反应生成二氧化碳,二氧化碳与氯化钙不反应,则④中无现象,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含2molFeBr2的溶液中通入1molCl2:2Fe2++Cl2═2Cl-+2Fe3+ | |
| B. | 向AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
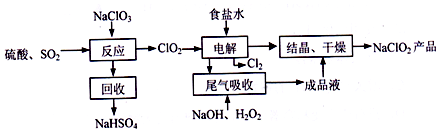
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金刚烷结构如图,其结构非常对称,1H-NMR谱中只有两个信号.
金刚烷结构如图,其结构非常对称,1H-NMR谱中只有两个信号.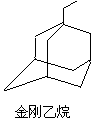 $→_{I}^{Cl_{2}}$M$→_{II}^{NH_{3}}$
$→_{I}^{Cl_{2}}$M$→_{II}^{NH_{3}}$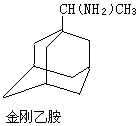
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TI3+>Fe3+>Ag+ | B. | Fe3+>Ag+>TI3+ | C. | Tl+>Ag+>Fe2+ | D. | TI3+>Ag+>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应速率减慢,逆反应速率加快,化学平衡向逆反应方向移动 | |
| B. | 增大压强,正反应与逆反应速率均增大,平衡不移动 | |
| C. | 增大A2(g)的浓度,化学平衡向正反应方向移动,A2的转化率增大 | |
| D. | 增大B的物质的量,化学平衡向正反应方向移动,A2的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com