
| 实验步骤 | 预期实验结果和结论 |
| ①取一定体积废水样品,分成体积相同两份,其中一份持续通入一段时间N2,以减少水中的溶解氧; | 若溶解氧不同的两份溶液中,测出的砷的浓度不同,则溶解氧对砷的去除效率有影响;反之则无影响. |
| ②向上述两份溶液中投入足量等质量的同种单质铁 | |
| ③相同一段时间后,用分光光度计测定两份水样中砷的浓度 |
分析 (1)反应物有Fe和O2,生成物有FeOOH,根据氧化还原反应得失电子守恒配平得化学方程式;
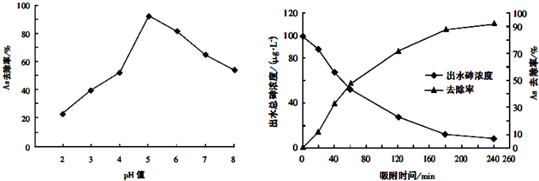
(2)由第(3)其他条件相同,调节水样的pH,得到除砷效率曲线为图1分析判断;
(3))①根据单质铁(经过处理)处理水体砷污染的原理为:单质铁或在水体中被氧化腐蚀得到水合氧化铁,水合氧化铁能吸附沉降砷的化合物(如:含AsO33-、AsO43-等物质)分析;
②根据图1可以看出:若控制水样的pH=6,则As的去除率大概为80%,此时水中剩余的As约为20%;由图2可以看出:污水没有开始处理时(当吸附时间为0时)水中As的浓度为100ug/L,水样的pH=6时,水中剩余的As为100ug/L×20%=20ug/L=0.02mg/L,据此判断;
(4)要测定溶解氧对砷的去除效率有无影响,则采用对比实验,即取2份不同溶解氧的相同体积水,向其中分别中投入足量等质量的同种单质铁,相同一段时间后,用分光光度计测定两份水样中砷的浓度,最终根据测定的砷的浓度是否相同判断有无影响.
解答 解:(1)单质铁在水体中被(O2)氧化腐蚀得到水合氧化铁(FeOOH),反应物有Fe和O2,生成物有FeOOH,反应化学方程式为:4Fe+3O2+2H2O=4FeOOH,
故答案为:4Fe+3O2+2H2O=4FeOOH;
(2)由第(3)其他条件相同,调节水样的pH,得到除砷效率曲线为图1,若控制水样pH=5时,测定不同时间段的除砷效率为图2,可知水样的pH对单质铁去除水体中的砷有一定的影响,故答案为:水样的pH;
(3)①单质铁(经过处理)处理水体砷污染的原理为:单质铁或在水体中被氧化腐蚀得到水合氧化铁,水合氧化铁能吸附沉降砷的化合物(如:含AsO33-、AsO43-等物质),若水样酸性较强时,单质铁容易被腐蚀,无法生成水和氧化铁,
故答案为:酸性较强时,单质铁被腐蚀后,无法生成水合氧化铁,吸附能力下降,除砷效率降低;
②其他条件相同,调节水样的pH,得到除砷效率曲线为图1,由图1可以看出:若控制水样的pH=6,则As的去除率大概为80%,此时水中剩余的As约为20%;由图2可以看出:污水没有开始处理时(当吸附时间为0时)水中As的浓度为100ug/L,水样的pH=6时,水中剩余的As为100ug/L×20%=20ug/L=0.02mg/L<0.05mg/L,国家饮用水标准规定水中砷的含量应低于0.05mg/L,故出水后的砷浓度达到饮用水标准,
故答案为:达到;
(4)要测定溶解氧对砷的去除效率有无影响,则采用对比实验,即取2份不同溶解氧的相同体积水,向其中分别中投入足量等质量的同种单质铁,相同一段时间后,用分光光度计测定两份水样中砷的浓度,最终根据测定的砷的浓度是否相同判断有无影响,
所以实验步骤为:
①取一定体积废水样品,分成体积相同两份,其中一份持续通入一段时间N2,以减少水中的溶解氧;
②向上述两份溶液中投入足量等质量的同种单质铁;
③相同一段时间后,用分光光度计测定两份水样中砷的浓度;
实验结果和结论为:若溶解氧不同的两份溶液中,测出的砷的浓度不同,则溶解氧对砷的去除效率有影响;反之则无影响;
故答案为:
| 实验步骤 | 预期实验结果和结论 |
| ①取一定体积废水样品,分成体积相同两份,其中一份持续通入一段时间N2,以减少水中的溶解氧; | 若溶解氧不同的两份溶液中,测出的砷的浓度不同, |
| ②向上述两份溶液中投入足量等质量的同种单质铁; | |
| ③相同一段时间后,用分光光度计测定两份水样中砷的浓度. |
点评 本题考查了探究影响单质铁去除一定量水体中砷的效率的因素,还考查了控制条件设计实验的能力,需要学生具备扎实的基础与运用知识分析解决问题的能力,难度中等.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:实验题
 NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| B. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0升高温度使平衡向逆方向移动 | |
| C. | 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H<0,为使氨的产率提高,理论上应采取低温高压的措施 | |
| D. | 在溴水中存在如下平衡:Br2(g)+H2O(l)?HBr(aq)+HBrO(aq),当加入NaOH溶液后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
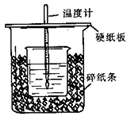 用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
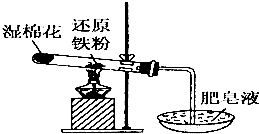 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
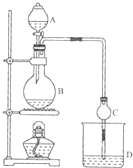 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com